ウィーランド・ミーシャーケトン
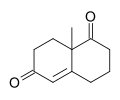
ウィーランド・ミーシャーケトン(英語:Wieland–Miescher ketone)は二環をもつジケトンのラセミ体である[2]。合成化学においてシントンとして幅広く用いられており、セスキテルペン類やジテルペン類、ステロイド類などの、抗発癌作用や抗生作用、抗ウイルス作用、抗神経変性作用、免疫調節活性などの生理活性を持つ可能性のある50以上の天然物の全合成に利用された。この物質名はチバガイギー社に所属していた2人の化学者、カール・ミーシャー(Karl Miescher)とピーター・ウィーランド(Peter Wieland)(ハインリッヒ・ヴィーラントとは別人)にちなんで名付けられた。このジケトンの光学活性を持つエナンチオマーが合成の出発物質に用いられた例として、アンシストロフラン(ancistrofuran)や[3]やダニシェフスキーのタキソール全合成などがある[4]。
| ウィーランド・ミーシャーケトン[1] | |
|---|---|
| |
8a-メチル-3,4,7,8-テトラヒドロ-2H-ナフタレン-1,6-ジオン | |
| 識別情報 | |
| CAS登録番号 | 20007-72-1 |
| PubChem | 89262 |
| ChemSpider | 80553 |
| |
| |
| 特性 | |
| 化学式 | C11H14O2 |
| モル質量 | 178.23 g/mol |
| 融点 |
47-50 °C, 320-323 K, 117-122 °F |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
全合成においてウィーランド・ミーシャーケトンを出発物質とする合成法は、1960年代から1970年代にかけて盛んに行われた避妊薬などに利用されるステロイドの工業生産の研究によって加速した[5]。ウィーランド・ミーシャーケトンはステロイドのAB環構造をもつため、アドレノステロンの合成などステロイド骨格を合成する際の出発物質として注目を集めている.[6]
元々のウィーランド・ミーシャーケトンはラセミ体であり、2-メチル-1,3-シクロヘキサンジオンとメチルビニルケトンのロビンソン環化反応によって作られる。反応中間体として生成するアルコールは単離されない[7]。2-メチル-1,3-シクロヘキサンジオンはレソルシノールをラネーニッケル上で水素化してジヒドロレソルシノールのエノラートとし、これをヨウ化メチルでアルキル化すると得られる[8]。
不斉合成の際にはL-プロリンが有機分子触媒として用いられる[9]。
この反応は1971年にヘイオース(Z. G. Hajos)、パリッシュ(D. R. Parrish)らによって特許文献発表された[10]。この文献では、上のカッコ内に示した光学活性を持つ二環式ケトール中間体の単離およびキャラクタリゼーションの方法も記述されている。これはこの反応が室温の無水ジメチルホルムアミド(DMF)溶媒中で進行するからである。ジメチルスルホキシドを溶媒として用いると二環式ケトールの単離はできないため、直接二環式ジオンが生成する[11]。この反応はヘイオース・パリッシュ・エダー・ザウアー・ウィーチャート反応、あるいはヘイオース・パリッシュ反応と呼ばれる[12][10]。
この反応は1段階で行うこともでき、収率は49%、鏡像体過剰率76%と報告されている[13]。
他のプロリンをベースとした触媒の研究も進められている[14]。
脚注 編集
- ^ (±)-8a-Methyl-3,4,8,8a-tetrahydro-1,6(2H,7H)-naphthalenedione - シグマ アルドリッチ
- ^ Wieland, P.; Miescher, K. Über die Herstellung mehrkerniger Ketone., Helvetica Chimica Acta 1950, 33, 2215. doi:10.1002/hlca.19500330730
- ^ Ciceri, Paola, Demnitz, F.W. Joachim, Souza, Márcia C.F. de, Lehmanna, Maik. A Common Approach to the Synthesis of Monocyclofarnesyl Sesquiterpenes. ブラジル化学会誌. 1998, 9, 409-414. ISSN 0103-5053. (Article)
- ^ Samuel J. Danishefsky, John J. Masters, Wendy B. Young, J. T. Link, Lawrence B. Snyder, Thomas V. Magee, David K. Jung, Richard C. A. Isaacs, William G. Bornmann, Cheryl A. Alaimo, Craig A. Coburn, and Martin J. Di Grandi (1996). "Total Synthesis of Baccatin III and Taxol". 米国化学会誌 118 (12): 2843-2859. doi:10.1021/ja952692a
- ^ Wiechert, R. The Role of Birth Control in the Survival of the Human Race. Angew. Chem. Int. Ed. 1977, 16, 506-513.
- ^ Dzierba, C. D.; Zandi, K. S.; Moellers, T.; Shea, K. J. An Ascending Synthesis of Adrenalcorticosteroids. The Total Synthesis of (+)-Adrenosterone. 米国化学会誌 1996, 118, 4711-4712.
- ^ ウィーランドとミーシャーの合成: a) 水、酢酸、ヒドロキノン (ケトンの安定化のため) b)L-プロリン、DMSO d) 水素、ラネーニッケル、水酸化ナトリウム e) ヨウ化メチル、ジオキサン. 比旋光度(英語版) 68°.
- ^ A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman オーガニック・シンセシズ, Coll. Vol. 5, p.743 (1973); Vol. 41, p.56 (1961). (Article)
- ^ 1,6(2H, 7H)-Naphthalenedione, 3,4,8,8a-tetrahydro-8a-methyl-, (S)- Paul Buchschacher, A. Fürst, and J. Gutzwiller Organic Syntheses, Coll. Vol. 7, p.368 (1990); Vol. 63, p.37 (1985). (Article)
- ^ a b ヘイオース・パリッシュ・エダー・ザウアー・ウィーチャート反応 - Chem-Station
- ^ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 (29 July 1971) and USP 3,975,440 (Aug.17, 1976) Example 21.
- ^ 1 H-Indene-1,5(6 H)-dione, 2,3,7,7a-tetrahydro-7a-methyl-, (S)- Zoltan G. Hajos and David R. Parrish Organic Syntheses, Coll. Vol. 7, p.363 (1990); Vol. 63, p.26 (1985) Article Identical reaction with 2-methyl-1,3-cyclopentanedione (5 membered ring instead of a 6 membered ring)
- ^ A proline-catalyzed asymmetric Robinson annulation reaction Tetrahedron Letters, Volume 41, Issue 36, September 2000, Pages 6951-6954 Tommy Bui and Carlos F. Barbas doi:10.1016/S0040-4039(00)01180-1
- ^ オーガニック・シンセシズ 2011, 88, 330-341 Link

