サバティエの原理
サバティエの原理(サバティエのげんり、英: Sabatier principle)は、化学不均一触媒における定性的概念である。名称はフランスの化学者ポール・サバティエに因む。本原理は、触媒と基質との間の相互作用は「ちょうどよい」でなければならない、すなわち強すぎても弱すぎてもいけない、と述べる。もし相互作用が弱すぎれば、分子は触媒に結合できず、反応が起こらない。一方、もし相互作用が強すぎれば、生成物が解離できない[1]。
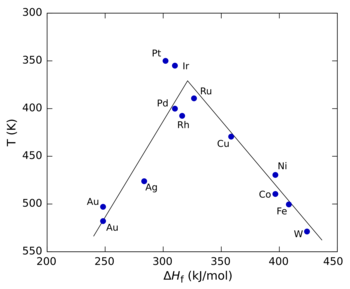
本原理は、触媒による反応物の吸着熱といった性質に対して反応速度をプロットすることによって視覚的に示すことができる。このようなプロットは最大値を通過し、三角形あるいは逆さまにした放物線のように見える。その形状から火山プロット(volcano plot)と呼ばれる[1]。2つの異なる性質(例えば2成分反応について2つの反応物の吸着熱)に対して類似した3次元プロットを構築することもできる。この場合、プロットは一般的に等値線図で示され、火山面(volcano surface)と呼ばれる[2]。火山プロットはBalandinによって導入された[3][4]。
右図は、触媒として異なる遷移金属を使用したギ酸の分解についての火山プロットを示す[5]。この場合、ギ酸金属塩の生成熱(ΔHf)がx軸に使われる。これは、反応中間体が表面ギ酸イオンであることが研究から示されているためである。y軸には、反応が特定の速度に達する温度が使われる(「火山」形を維持するためにy軸は逆にプロットされている)。低いΔHf値では、吸着速度が遅く、律速であるため、反応は遅い(言い換えると、高温を必要とする)。高いΔHf値では、脱着が律速段階となる。最大反応速度(この場合白金族金属で観測される)は中間的なΔHfの値を必要とする(反応速度は吸着速度と脱着速度の組合せである)[3]。
出典 編集
- ^ a b Gadi Rothenberg (2008). Catalysis: Concepts and Green Applications. Wiley-VCH. pp. 65. ISBN 978-3-527-31824-7
- ^ Jun Cheng; P. Hu (2008). “Utilization of the Three-Dimensional Volcano Surface To Understand the Chemistry of Multiphase Systems in Heterogeneous Catalysis”. J. Am. Chem. Soc. 130 (33): 10868–10869. doi:10.1021/ja803555g. PMID 18651740.
- ^ a b Helmut Knözinger; Karl Kochloefl (2005). “Heterogeneous Catalysis and Solid Catalysts”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag. doi:10.1002/14356007.a05_313. ISBN 3527306730
- ^ Balandin, A. (1969). “Modern State of the Multiplet Theory of Heterogeneous Catalysis1”. Adv. Catal. Rel. Subj.. Advances in Catalysis 19: 1–210. doi:10.1016/S0360-0564(08)60029-2. ISBN 9780120078196.
- ^ Rootsaert, W. J. M.; Sachtler, W. M. H. (1960). “Interaction of Formic Acid Vapour with Tungsten” (英語). Zeitschrift für Physikalische Chemie 26: 16–26. doi:10.1524/zpch.1960.26.1_2.016. ISSN 0942-9352.