ジボラン
ジボラン (英: diborane、B2H6) は、ホウ素の水素化物。狭義のボラン(モノボラン、BH3)の二量体として存在する。
| ジボラン | |
|---|---|

| |
| |
ジボラン | |
| 識別情報 | |
| CAS登録番号 | 19287-45-7 |
| RTECS番号 | HQ9275000 |
| 特性 | |
| 化学式 | B2H6 |
| モル質量 | 27.67 g/mol |
| 外観 | 無色の気体 |
| 密度 | 1.18 g/l, 気体 (15 ℃) |
| 融点 |
-165 ℃ (108.15 K) |
| 沸点 |
-92.5 ℃ (180.65 K) |
| 水への溶解度 | 反応 |
| 構造 | |
| 配位構造 | 四面体形(BH4単位において) |
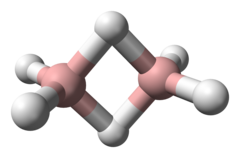
| 分子の形 | 画像参照 |
| 双極子モーメント | 0 D |
| 熱化学 | |
| 標準生成熱 ΔfH |
35.6 kJ mol-1 |
| 標準モルエントロピー S |
232.11 J mol-1K-1 |
| 標準定圧モル比熱, Cp |
56.90 J mol-1K-1 |
| 危険性 | |
| GHSピクトグラム |     
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H220, H280, H314, H318, H330, H370, H372 |
| Pフレーズ | P210, P260, P264, P270, P271, P280, P284, P301+330+331, P303+361+353, P304+340, P305+351+338, P307+311, P310, P314 |
| NFPA 704 | |
| 引火点 | 可燃性の気体 |
| 発火点 | 38 ℃ |
| 関連する物質 | |
| 関連するホウ素の化合物 | デカボラン フッ化ホウ素 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
単体は無色で、特徴的な甘い臭気を持つ気体。分子量は 27.67(空気を1とした場合の比重は 0.965)。融点は -164.9 ℃、沸点は -92.8 ℃。CAS登録番号は 19287-45-7。
ジボランは水素化ホウ素ナトリウム (NaBH4) を硫酸で加水分解するか、BF3 や BCl3 と処理すると得られる。
性質 編集
酸素および水分を遮断した状態では 25 ℃ において安定であるが、湿気のある空気中では低温においても自然発火する。水により瞬時に加水分解し、ホウ酸 (H3BO3) と水素を生じる。空気を遮断して 100 ℃ に加熱すると B10H14 など、より高次のボラン類を生成する。
エーテルなどの溶媒中でアルケンと反応させると、単量体に解離したモノボランに付加反応を起こし、ヒドロホウ素化反応が起こる。
ジボランの構造 編集
ジボランの、水素-ホウ素間の4個の電子のうち2個(ホウ素-水素-ホウ素の結合)は、ホウ素の空軌道を使っている。水素-ホウ素結合で結びついている4個の水素原子と2個のホウ素原子は同一平面上に位置するが、ホウ素-水素-ホウ素の結合の中間に位置する2つの水素原子は平面の上下にある。このような結合を三中心二電子結合と呼ぶ。
ジボランの用途 編集
ジボランは半導体材料ガスとして重要である。重合触媒や還元剤、ロケットの推進剤としても役立つ。ただし、引火性が高く、爆発性で、さらに毒性が高い。
ジボランを用いると、半導体表面にホウ素をドープ(添加)できる。シリコン膜上にホウ素をドープすると、電子の不足した領域、すなわちp型のシリコン膜を形成できる。なお、n型のシリコン膜を形成するには電子が過剰なヒ素をドープすればよいため、アルシンを用いる。単なるシリコン薄膜形成にはシラン(モノシラン)やジクロロシランが適する。
ジボランをドープするには化学気相成長 (CVD) 装置などの真空チャンバーを用いる。水素をキャリア(薄めるガス)としたジボランを通じ、放電を起こすことでドープできる。また、他のボラン類の合成材料ともなる。
ジボランの危険性 編集
ジボランの自然発火温度は 38 ℃ - 52 ℃ と低く、爆発範囲は 0.8 - 98 % と広い。ホウ酸と爆発性の高い水素に分解しやすいことから、高圧ガス保安法では「その消費に際し災害の発生を防止するため特別の注意を要するものとして政令で定める種類」として、ジボランを含む、モノシラン、アルシンをあらかじめ定めている。
ジボランの1日8時間作業の許容濃度は 0.1 ppm(TLV-TWA: Threshold Limit Values-Time Weighted Average、時間加重平均許容濃度)である。吸入すると咳や息苦しさを覚え、脱力感を覚えるという。なお、アルシンの許容濃度は 0.005 ppm である。

