ニバレノール
この項目「ニバレノール」は途中まで翻訳されたものです。(原文:https://en.wikipedia.org/w/index.php?title = Nivalenol&oldid = 1028740483) 翻訳作業に協力して下さる方を求めています。ノートページや履歴、翻訳のガイドラインも参照してください。要約欄への翻訳情報の記入をお忘れなく。(2021年8月) |
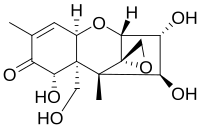
ニバレノール(Nivalenol,NIV)はトリコテセン類のマイコトキシンである。自然界では主にFusarium 種の真菌に含まれている。Fusarium 種は、北半球の温帯地域で最も一般的なマイコトキシン生産菌に属しており、そのため、食用作物生産産業にとって大きなリスクとなっている[4]。
| ニバレノール | |
|---|---|
| |
別称 (3α,4β,7α)-12,13-epoxy-3,4,7,15-tetrahydroxy-trichothec-9-en-8-one[1] | |
| 識別情報 | |
| CAS登録番号 | 23282-20-4 |
| PubChem | 31829 |
| ChemSpider | 29515 |
| UNII | 5WOP02RM1U |
| KEGG | C06080 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | C15H20O7 |
| モル質量 | 312.32 g mol−1 |
| 外観 | solid |
| 密度 | 1.6±0.1 g/cm3 |
| 融点 |
222–223 ℃ |
| 沸点 |
585.1±50 ℃ |
| 水への溶解度 | 3.54*10^5 mg/L at 25 ℃ |
| 溶解度 | soluble in polar organic solvents |
| 酸解離定数 pKa | 11.78 |
| 危険性 | |
| GHSピクトグラム |    [2][3] [2][3]
|
| GHSシグナルワード | Danger [2] |
| Hフレーズ | H225, H300, H302, H312, H332, H310, H319, H330 [2][3] |
| Pフレーズ | P210, P241, P260, P262, P264, P270, P271, P280, P284, P301+310, P302+350, P304+340, P310, P320[2][3] |
| NFPA 704 | |
| 引火点 | 5 °C (41 °F; 278 K) [3] |
| 発火点 | 525 °C (977 °F; 798 K) [3] |
| 許容曝露限界 | 40 ppm (70 mg/m3) [3] |
| 半数致死量 LD50 | 19.5 mg/kg (rats, oral), 38.9 mg/kg (mouse, oral) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
この真菌は、さまざまな農産物(穀物)やその加工品(麦芽、ビール、パン)に多く含まれている。Fusarium 種は農作物に侵入して成長し、湿った涼しい環境下でニバレノールを生成する可能性がある[4]。
ニバレノールの影響を受けた後に観察される症状は、飼料拒否、嘔吐、胃腸や皮膚の炎症や壊死、免疫機能障害[5]であり、また、白血球数低下をもたらす血液毒である[5]。
歴史 編集
1946年から1963年にかけて、日本、韓国、インドでFusarium に感染した穀物を摂取したことによる中毒症状(赤カビ病、Scrabby grain disease)が数例報告された。致死的な症例は報告されておらず、吐き気、嘔吐、下痢、腹痛などの軽い症状のみであった。これらの事例ではF.graminaerumが分離され、ニバレノールまたはデオキシニバレノールの混入が示唆された。
同時期に、インドと中国で100人以上の患者を伴う2つのアウトブレイクが報告された。これらのアウトブレイクでも死に至った症例は報告されなかった。
1987年にインドで発生した急性のアウトブレイクでは、約50,000,000人が罹患したことが記録されている。パン製造に使用された雨晒しの小麦から、ニバレノール(24サンプル中2サンプルで0.03 - 0.1 mg/kg)、デオキシニバレノール(24サンプル中11サンプルで0.34 - 8.4 mg/kg)、アセチルデオキシニバレノール(24サンプル中4サンプルで0.6 - 2.4 mg/kg)などの複数のFusarium 毒素が検出された。致死的な症例は今回もなく、報告された症状は腹痛、下痢、血便、嘔吐であった。これらの事例は、ニバレノールの主な危険性はフザリウムに感染した穀物に由来し、主に管理されていない小麦やその他の穀物の流通ルートを経由して、さらに加工されたり、別のルートで食物連鎖に入ったりすることを示している[6]。
ニバレノール中毒の武器化とその他の事例 編集
Nivalenol as well as deoxynivalenol and T-2 toxin have been used as biological warfare agents in Laos and Cambodia as well as in Afghanistan. The Soviet Union has been alleged to have provided the mycotoxins and to have used them themselves in Afghanistan. All three compounds could be identified in the vegetation at affected sites, whereas T-2 toxin could also be found in urine and blood samples of victims.[7]
The best documented use of trichothecenes in warfare is the yellow rain controversy, this describes a number of attacks in Southeastern Asia as well as Laos and Afghanistan, which used a “yellow rain” as described by witnesses. The toxins were delivered as what has been described as a cloud of yellow dust or droplets. An article by L. R. Ember published in 1984 in Chemical Engineering News describes the use of trichothecene mycotoxins as biological weapons in Southeast Asia in a very detailed manner.[8] In it reports of survivors and eyewitnesses as well as prisoners of war and soviet informants can be found together with information on the presence of soviet technicians and laboratories. This led to the conclusion that these toxins have been used in Southeast Asia and Afghanistan. The Russian government however refuses to give a statement on these pieces of evidence. Furthermore, it has been shown that samples taken on the location of attacks contain these toxins, while sites that have not been attacked do not show any signs of toxins in them.
Even though it remains questionable if all witness reports are reliable sources of evidence, the symptoms recorded are typical for intoxication with trichothecenes.
There was a number of ways in which trichothecenes were weaponized, such as dispersion as aerosol, smoke, droplets or dust from aircraft, missiles, handheld devices or artillery.[9]
食品業界における安全性ガイドライン 編集
2000年に欧州の食品科学委員会(SCF)からニバレノールに関する科学的意見が公表された。一般毒性、血液毒性、免疫毒性を評価した結果、一時的耐容一日摂取量(t-TDI)がは0-0.7μg/kg体重/日であると発表された。このt-TDIは2002年にSCFによって再確認された。
日本の食品安全委員会(FSCJ)は2010年にt-TDIを0.4μg/kg体重/日とした。
欧州食品安全機関(EFSA)は、2001年から2011年にかけて、欧州18カ国で発生した15,774件のニバレノールのデータを収集し、評価を行った。その結果、TDIを1.2 μg/kg体重/日と設定した。この研究では、ニバレノールには遺伝毒性は認められなかったが、血液毒性と免疫毒性は認められた[4]。
構造と反応性 編集
マイコトキシンファミリーの一員であるニバレノールは、この毒素ファミリーのすべてのメンバーが持つ共通の構造を持っている。この構造は、シクロヘキセンとテトラヒドロピランがC6とC11で縮合した基本構造を含んでいる。さらに、テトラヒドロピランのC2とC5はエチレン基で結ばれており、シクロヘキセンのC8にはケト基が結合している。テトラヒドロピランのC12とC13には、ほとんどのメンバーで反応性を担うエポキシド基が結合している。C3,C4,C7,C15の残りの基だけが,それぞれのマイコトキシンで異なる。ニバレノールの場合、残りの4つの基はそれぞれ置換されたヒドロキシル基であり、それらの極性特性のため、親水性化合物やサブグループの存在下での反応性を高めている。酸性媒体中では、ケト基はプロトンと反応して、極性と反応性を促進することができる。しかし、全体としては、エポキシド基が分子の反応性にとって最も重要である[10]。
生合成 編集
ニバレノールの合成は16段階のプロセスで行われる。反応を制御するトリコジエン合成酵素TRI1、TRI13、TRI7の触媒作用の順番によって、ステップ11からステップ14まで異なることがある。ニバレノールの合成には、ファルネシル二リン酸が出発物質として用いられる。そのトリコジエンへの環化反応は、テルペンシクラーゼのトリコジエン合成酵素(TRI5にコードされている)によって触媒される。この反応に続いて、シトクロムP450モノオキシゲナーゼ(TRI4)が幾つかの酸化反応を触媒する。これにより、C2、C3、C11の炭素原子に水酸基が置換され、C12、C13に酸素が1つ追加されてエポキシド基が形成されやすくなる。これにより、中間体のイソトリコトリオールが得られる。
さらに、イソトリコトリオールのC11水酸基がC9にシフトすることで、二重結合がC9=C10からC10=C11にシフトし、トリコトリオールが得られる。トリコトリオールは、非酵素的な環化反応により、その異性体であるイソトリコデルモールへと変化する。この反応では、シクロペンタンのC2にある水酸基がシクロヘキセンのC11に結合してテトラヒドロピラン環を形成する。C9のシフトした水酸基は反応中に失われる。TRI101にコードされているアセチル転移酵素は、イソトリコデルモールのC3水酸基のアセチル化を触媒し、イソトリコデルミンを生成する。
イソトリコデルミンは、TRI11がコードするC15の水素と水酸基の置換により、15-デカロンネクトリンに変換され、TRI3の助けによりアセチル化され、カロネクトリンとなる。同じ置換反応とそれに続くアセチル化反応が、TRI13とTRI7の制御下でC4で再び起こる。F.sporotrichiodies のTRI1はさらに、C8に4つ目のOH基、C7に5つ目のOH基の付加を触媒し、C8では水素が除去されてケト基が形成され、最後に、TRI8が制御するエステラーゼがC3、C4、C15の脱アセチル化を触媒し、最終生成物のニバレノールが得られる。
カロネクトリンに触媒を逆順のTRI1、TRI13、TRI7と作用させると、一部の構造が異なるものが合成されるが、最終的にニバレノールが生成される。カロネクトリンに、TRI1で制御されたC7とC8の水酸基の付加が起こると、7,8-ジヒドロキシカロナクトリンが生成し、さらに水素の脱離とC8のケト基の形成を経て、3,15-ジアセチルデオキシニバレノールに自然に変化する。TRI13の制御によりC4に水酸基の付加が起こり、TRI7の助けによりアセチル化される。これにより、3,4,15-トリアセチルニバレノール(3,4,15-triANIV)が得られ、これを元に再び上述と同様にニバレノール(NIV)が生成される[9]。
3,15-ジアセチルデオキシニバレノールにTRI13水酸化酵素でなくTRI8エステラーゼが作用するとデオキシニバレノール(DON)が生成される。
作用機序 編集
ニバレノールは、多くの異なる生物学的経路に変化をもたらす。最もよく知られており、おそらく重要なのはNF-κB経路である。NF-κBは、ほとんどのヒトの細胞に存在する転写因子で、ゲノムDNA上の特定のモチーフに結合することで、標的遺伝子の発現を制御する。ニバレノールは、免疫系の重要な制御分子であるサイトカインの発現を変化させることが、in vitro の実験で明らかになっている。ニバレノールは、炎症のメディエーターであるIL-8の分泌を誘導した。NF-κB阻害剤を投与すると、IL-8の分泌量が減少した。ニバレノールの影響を受けるもう一つの重要な因子はMCP-1/CCL2で、このサイトカインは単球細胞の運動性調節の役割を果たしている。ニバレノールはCCL2の分泌を低下させ、その結果、単球の移動性を低下させる。このことは、ニバレノールの免疫抑制作用の一部を説明している。また、この効果はNF-κBを阻害すると減少することから、ニバレノールとNF-κBが相互に作用して細胞に影響を与えていることが判る[11][12]。
デオキシニバレノールは、免疫関連のメッセンジャー分子でもあるケモカインの分泌を誘導するが、ニバレノールはその分泌を抑制することが示された[13][12]。また、ニバレノールはマクロファージの炎症性遺伝子の発現を上昇させ、異なる細胞種に混合して作用することが判明した。これは細胞毒性レベルでも同じである[14]。
ニバレノールの細胞毒性のもう一つのメカニズムは、アポトーシスによる細胞毒性であり、ニバレノールは、しばしば共存するマイコトキシンのパートナーであるデオキシニバレノールよりも毒性が強く、DNA損傷とアポトーシスを引き起こすことでその効果を発揮する[15]。また、ニバレノールはヒト白血球の増殖に影響を与えることが知られている。ニバレノールは、ヒト白血球の増殖率を用量依存的に変化させることが示されている。低濃度では白血球の増殖が促進され、高濃度では用量依存的に増殖が抑制されることが知られている[16]。
代謝 編集
ニバレノールは、マウスでは肝臓で代謝されるだけでなく、一部は腸内の微生物による解毒によっても代謝される。これにより、分子の中でも特に毒性の高いエポキシド基が分解される。エポキシド基の酸素を除去することで、C12とC13の間に炭素-炭素の二重結合が生じる。この二重結合は非極性で非常に安定しており、脱エポキシ化ニバレノールと呼ばれる反応性の低い形態のニバレノールとなる。このようにして得られた脱エポキシ化ニバレノールは、脱エポキシ化トリコジエンと同様に毒性が非常に低く、尿中に排出されても毒性はほとんどない(ほぼ無毒性)。
実験したマウスとブタの尿中には、脱エポキシ化された化合物が80%、未変化体のニバレノールは僅か7%しか検出されず、トリコジエンの高い代謝率が示された[5]。また、尿中尿素窒素濃度が低く、コレステロール濃度が通常よりも高いことが確認された。肝臓はコレステロールの血流からの取り込みを担当していることから、このことは、ニバレノールが存在し、肝臓の分解負荷が高いことを示唆している。血中のコレステロールの量が増えると、腎臓で濾過されるコレステロールの量も増え、最終的には尿中の濃度が上昇することになる[10][17]。アミドの濃度が低下するのは、反応性の高いエポキシド基の分解過程に起因すると考えられる。エポキシドはアミド(基)の一級または二級アミンに付加して水酸基となる反応が多く見られる。その結果、エポキシド基が分解され、タンパク質や尿素の合成に必要な窒素が少なくなると思われる。
家畜などへの影響 編集
As nivalenol is a mycotoxic product of certain Fusarium species it is often found in infected wheat and grain. As unprocessed wheat and grain product are often used as feed for livestock animals these are at a higher risk of nivalenol intake.
Toxicity studies in swine that received a dose of 0.05 mg nivalenol/kg body weight twice daily showed no lethal effects. Most nivalenol was secreted with the feces and did not reach the bloodstream despite the fact that there was still nivalenol upstage over the intestines after 16 hours of feeding. There were further no nivalenol metabolites found in feces or urine within the first three days.[18] After a week of exposure to 2.5 or 5 mg nivalenol kg bw twice a day a microbiological adaptation was seen as nivalenol metabolites (de-epoxidated nivalenol) could be found in feces and urine.
In rats and mice nivalenol showed to be toxic with adverse effects of growth retardation and leukopenia already noticed at lowest doses of 0.7 mg/kg bw per day. Lethal doses were dependent on the route of administration/intake of nivalenol. As nivalenol is normally taken up with feed the LD50 of oral administration which is 38.9 mg/kg bw per day in mice and 19.5 mg/kg bw per day in rats can be used as standard. The LD50 of intravenous, intraperitoneal and subcutaneous (SC) is between 7 and 7.5 mg/kg bw per day.[19]
毒性の詳細 編集
The toxicity of nivalenol in humans is for the most parts unknown yet, but it was investigated in mice, rats and hamster cells. Thereby the toxicity was divided in the following topics: acute/subacute, subchronic, chronic and carcinogenicity, genotoxicity, developmental toxicity studies and studies on reproduction, immunotoxicity/hematotoxycity and effects on nervous system.
Acute/subacute toxicity 編集
The oral LD50 of nivalenol was found to be 38.9 mg/kg bw in mice whereas the intraperitonal, subcutaneous and intravenous routes of exposure gave LD50 values of 5–10 mg/kg bw. In mice already within 3 days the most deaths occurred after oral exposure through marked congestion and haemorrhage in intestine, in acute toxicity also lymphoid organs are included. Nivalenol given over time periods of 24 days in lower doses (ca. 3,5 mg/kg bw) showed significant erythropenia and slight leukopenia.[19]
Subchronic toxicity 編集
The subchronic toxicity was tested by feeding mice with a daily dose of 0 to 3.5 mg nivalenol/ kg bw for 4 or 12 weeks. The observations after 4 weeks were reduced body weight and food consumption. The reduction in body weight can be explained by statistical decrease in organ weight in thymus, spleen and kidneys. Whereas the consumption time was less for female mice in comparison to male mice. After 12 weeks the toxin consumption resulted in reduction of relative organ weight in both males and females. Hereby only the liver was affected and no histopathological changes were observed.[19]
Chronic toxicity and carcinogenicity 編集
Female mice were fed with different doses of nivalenol (0, 0.7, 1.4 or 3.5 mg nivalenol /kg bw) for one or two years to investigate whether nivalenol is chronic toxic and/or carcinogenic. Also during this study a decrease in body weight and feed consumption was observed. The absolute weight of both liver and kidney was decreased through the two highest doses. The mice fed for one year with nivalenol (also with the lower doses) were affected with severe leukopenia whereas the mice fed for two years had no differences in count of white blood cells. Also "no histopathological changes including tumours were found in liver, thymus, spleen, kidneys, stomach, adrenal glands, pituitary glands, ovaries, bone marrow, lymph node, brain and small intestines with or without Peyer's patch".[19] The lowest doses (0.7 mg nivalenol /kg bw) inhibited the growth and caused leukopenia. "A no observable adverse effect level (NOAEL) could not be derived from these studies. IARC (1993) concluded that there is inadequate evidence of carcinogenicity of nivalenol in experimental animals. No human data were available. The overall conclusion was that the carcinogenicity was not classifiable (group 3)".[19]
Genotoxicity 編集
It was found that nivalenol effects the genes of Chinese hamster V79 (CHO) cells by slightly increased frequencies of chromosomal aberrations and sister chromatid exchange. The DNA was damaged in CHO cells as well as in mice. In mice (given 20 mg nivalenol /kg bw orally or 3.7 mg /kg bw ip) the DNA of kidney, bone marrow, stomach, jejunum and colon was damaged. The DNA of the thymus and liver was not effected. In organs with DNA damage no necrotic changes were found upon histopathological examination. It can be concluded that an adequate evaluation of the genotoxicity is not allowed based on the available data.[19]
Developmental toxicity and studies on reproduction 編集
For developmental and reproduction studies pregnant mice were injected with different amounts of purified nivalenol on days 7–15 of gestation and for one additional study with mouldy rice containing nivalenol. The studies showed that the toxin is embryotoxic in mice. No evidence of teratogenicity was given. "The LOAEL in reproduction studies with nivalenol given by oral exposure was stated to be 1.4 mg/kg bw given in the feed throughout gestation and 5 mg/kg bw when given by gavage on days 7–15".[19] Data from other species and on reproductive effects in adult males and females are not provided yet.[19]
Immunotoxicity/haematotoxicity 編集
Acute toxicity of nivalenol induces bone marrow toxicity and toxicity of lymphoid organs. Long-term exposure may result in erythropenia and/or leukopenia. In mice it was also observed that nivalenol increased the presence of serum IgA, "accompanied by immunopathological changes in kidneys analogous to human IgA-nephropathy".[19] The blastogenesis in cultured human lymphocytes, proliferation of human male and female lymphocytes stimulated with phytoheamagglutin and pokeweed and immunoglobulin production induced by pokeweed, are inhibited by nivalenol. The effects of nivalenol are in the same range as same doses of deoxynivalenol, whereas the T-2 toxin are 100 fold more toxic. An additive effect is gained by combination of nivalenol with T-2 toxin, 4,15-diacetoxyscirpenol or deoxynivalenol.[19]
Effects on nervous system 編集
About the nervous system no data has been provided yet.[19]
関連項目 編集
ニバレノール、デオキシニバレノール、T2 トキシンは、いずれも真菌(Fusarium など)に天然に存在する類縁化合物である[10]。
出典 編集
- ^ a b “Nivalenol”. Cayman Chemical. 2018年3月28日閲覧。
- ^ a b c d “= Top Nivalenol”. PubChem. 2018年3月28日閲覧。
- ^ a b c d e f “Nivalenol”. Safety Data Sheet. 2018年3月28日閲覧。
- ^ a b c “Scientific Opinion on risks for animal and public health related to the presence of nivalenol in food and feed”. European Food Safety Authority (EFSA) Journal 11 (6): 1-5. (2013).
- ^ a b c Hedman, R.; Pettersson, H.; Lindberg, J.E. (2009). “Absorption and metabolism of nivalenol in pigs”. Archiv fur Tierernaehrung 50-1 (1): 13-24. doi:10.1080/17450399709386115. PMID 9205733.
- ^ EFSA CONTAM Panel (EFSA Panel on Contaminants in the Food Chain) (2013). “Scientific Opinion on risks for animal and public health related to the presence of nivalenol in food and feed”. EFSA Journal 11 (6): 3262. doi:10.2903/j.efsa.2013.3262.
- ^ Gupta, R. C., ed (2015). Handbook of Toxicology of Chemical Warfare Agents. Academic Press. pp. 353-369. ISBN 9780128001592
- ^ Venkataramana, M.; Chandranayaka, S.; Prakash, H. S.; Niranja, R. (2014). “na, S. (2014). Mycotoxins Relevant to Biowarfare and Their Detection”. Biological Toxins and Bioterrorism: 22. doi:10.1007/978-94-007-6645-7_32-1.
- ^ a b c McCormick, S. P.; Stanley, A. M.; Stover, N. A.; Alexander, N. J. (2011). “Trichothecenes: From Simple to Complex Mycotoxins”. Toxins 3 (7): 802-814. doi:10.3390/toxins3070802. PMC 3202860. PMID 22069741.
- ^ a b c d Sidell, F. R.; Takafuji, E. T.; Franz, D. R. (1997). Medical Aspects of Chemical and Biological Warfare. United States Government Printing. pp. 662-664. ISBN 978-9997320919
- ^ US National Library of Medicine. “HSDB: Hazardous Substances Data Bank”. 2018年3月23日閲覧。
- ^ a b Deshmaneand, S. L.; Kremlev, S.; Amini, S.; Sawaya, B. E. (2009). “Monocyte Chemoattractant Protein-1 (MCP-1): An Overview”. Journal of Interferon & Cytokine Research 29 (6): 313-326. doi:10.1089/jir.2008.0027. PMC 2755091. PMID 19441883.
- ^ Nagashima, H. (2012). “Environ Toxicol Pharmacol”. Environmental Toxicology and Pharmacology 34 (3): 1014-1017. doi:10.1016/j.etap.2012.07.008. PMID 22964157.
- ^ Sugita-Konishi, Y.; Pestka, J. J. (2001). “Differential upregulation of TNF-alpha, IL-6, and IL-8 production by deoxynivalenol (vomitoxin) and other 8-ketotrichothecenes in a human macrophage model.”. Toxicol Environ Health A 64 (8): 619-636. doi:10.1080/152873901753246223. PMID 11766169.
- ^ Minervini, F. (2004). “Toxicity and apoptosis induced by the mycotoxins nivalenol, deoxynivalenol and fumonisin B1 in a human erythroleukemia cell line”. Toxicol in Vitro 18 (1): 21-28. doi:10.1016/S0887-2333(03)00130-9. PMID 14630058.
- ^ Taranu, I. (2010). “Comparative aspects of in vitro proliferation of human and porcine lymphocytes exposed to mycotoxins.”. Arch Anim Nutr. 64 (5): 383-393. doi:10.1080/1745039X.2010.492140. PMID 21114234.
- ^ Sundstøl Eriksen, G.; Pettersson, H.; Lundh, T. (2004). “Comparative cytotoxicity of deoxynivalenol, nivalenol, their acetylated derivatives and de-epoxy metabolites”. Food and Chemical Toxicology 42 (4): 619-624. doi:10.1016/j.fct.2003.11.006. PMID 15019186.
- ^ Pettersson, H.; Hedman, R. (1997). “Toxicity and metabolism of nivalenol in farm animals”. Cereal Research Communications (Akadémiai Kiadó) 25-3 (3): 423-427. doi:10.1007/BF03543746.
- ^ a b c d e f g h i j k “Opinion of the Scientific Committee on Food on Fusarium Toxins Part 41: Nivalenol”. Scientific Committee on Food: 2-6. (2000).
