五フッ化塩素
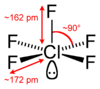
五フッ化塩素(ごフッかえんそ、英: Chlorine pentafluorideは化学式ClF5 で表される、フッ素と塩素からなるハロゲン間化合物。1963年に初めて合成された[1]。四角錐形の分子構造を持つ[2]。
| 五フッ化塩素 Chlorine pentafluoride | |
|---|---|
|

|
| 識別情報 | |
| CAS登録番号 | 13637-63-3 |
| PubChem | 61654 |
| RTECS番号 | FO2975000 |
| 特性 | |
| 化学式 | ClF5 |
| モル質量 | 130.445 g mol−1 |
| 外観 | 無色の気体 |
| 密度 | 4.5 g/cm3 |
| 融点 |
−103℃ |
| 沸点 |
−13.1℃ |
| 水への溶解度 | 加水分解 |
| 構造 | |
| 分子の形 | 四角錐形 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−238.49 kJ mol−1 |
| 標準モルエントロピー S |
310.73 J K−1 mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
生成 編集
当初は三フッ化塩素とフッ素とを高温高圧下で反応させた。また、四フッ化塩素カリウム(KClF4)や四フッ化塩素ルビジウム(RbClF4), 四フッ化塩素セシウム(CsClF4)などとフッ素との反応により五フッ化塩素とフッ化カリウム・フッ化ルビジウム・フッ化セシウムが生成する。1981年には、フッ化ニッケル(II)が五フッ化塩素生成のための優れた触媒であることが発見された[3]。
反応 編集
加水分解により、過塩素酸フッ素(fluorine perchlorate、FClO4)とフッ化水素を生じる[4]。強力なフッ素化剤であり、衝撃により三フッ化塩素とフッ素とに分解する[5]。
脚注 編集
- ^ Smith D. F. (1963). “Chlorine Pentafluoride”. Science 141 (3585): 1039–1040. doi:10.1126/science.141.3585.1039. PMID 17739492.
- ^ Pilipovich, D., Maya, W., Lawton, E.A., Bauer, H.F., Sheehan, D. F., Ogimachi, N. N., Wilson, R. D., Gunderloy, F. C., Bedwell, V. E. (1967). “Chlorine pentafluoride. Preparation and Properties”. Inorganic Chemistry 6 (10): 1918. doi:10.1021/ic50056a036.
- ^ Šmalc, A., Žemva, B., Slivnik, J., and Lutar K. (1981). “On the Synthesis of Chlorine Pentafluoride”. Journal of Fluorine Chemistry 17: 381–383. doi:10.1016/S0022-1139(00)81783-2.
- ^ Pradyot Patnaik (2007). A comprehensive guide to the hazardous properties of chemical substances (3rd ed.). Wiley-Interscience. pp. 478–479. ISBN 0471714585
- ^ 薄膜形成装置の表面清浄に三フッ化塩素を用いる方法(j-platpat)
| ハロゲン間化合物 | |||||
|---|---|---|---|---|---|
| フッ素 | 塩素 | 臭素 | ヨウ素 | アスタチン | |
| フッ素 | F2 | ||||
| 塩素 | ClF ClF3 ClF5 | Cl2 | |||
| 臭素 | BrF BrF3 BrF5 | BrCl BrCl3 | Br2 | ||
| ヨウ素 | IF IF3 IF5 IF7 | ICl I2Cl6 | IBr IBr3 | I2 | |
| アスタチン | AtCl | AtBr | AtI | At2? | |