「Β-ラクタム」の版間の差分
ページ「Beta-lactam」の翻訳により作成 |
(相違点なし)
|
2017年3月24日 (金) 11:07時点における版
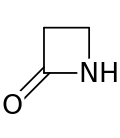
β-ラクタム (ベータ-ラクタム)とは四環のラクタムで[1] (ラクタムは、環状アミドです。) これは、窒素原子がカルボニルに対してβ-炭素原子に結合しているため、そのように命名される。 合成可能な最も単純なβ-ラクタムは2-アゼチジノンである。
臨床的意義
β-ラクタム環は複数の 抗生物質の核となる構造で、主なものにpenicillinsは、 cephalosporinsは、 カルバペネム系、 monobactamsることも呼ばれる β-ラクタム抗生物質です。 ほぼすべてのこれらの抗生物質の働抑制による細菌 細胞壁 生合成します。 この致死効果 菌します。 細菌は、しかし、含内の人口は、量が少なく、細菌る 耐性 に対するβ-ラクタム抗生物質です。 い表現の多くは β-ラクタマーゼ 遺伝子です。 以上1,800異なるβ-ラクタマーゼ酵素が記録されている各種の細菌です。[2] これらの酵素が大きく異なりますので、その化学構造および触媒の効率化します。[3] が細菌集団においてこれらの耐性グループは、処理とβ-ラクタムの耐ひずみが蔓延してより強毒します。
歴史
最初の合成とβ-ラクタムして作製した ヘルマンStaudinger 1907年の反応による シッフ塩基 の アニリン および 有 と diphenylketene[4][5] 、[2+2] 環化付加 (Phはフェニル機能グループ):
最1970年、β-ラクタムの研究に関する ペニシリン 、 cephalosporin 団体が、それ以来、多種多様な構造が記述されている。[6]
合成
反応性
による リングひずみ、βが急務であり反応性を 加水分解 条件以上のリニアアミドまたは拡大が急務です。 この歪みがさらに増の融合による第二のリングは、ほとんどのβ-ラクタム抗生物質です。 この傾向はよりアミドのβ-ラクタムを軽減している aplanarity のシステムです。 の窒素原子のアミドは sp2-ハイブリッド化 による 共振や、sp2-ハイブリッド化して原子において 三角形型の平面結合の形状です。 として の神経 結合の形状は強制的に窒素原子を環ひずみに共鳴のアミド結合が低下し、時にはカルボニルが ケトン。 ノーベル賞を受賞 どのウッドワード に記載のパラメータ h を測定することによって、高さの三方配列のピラミッドで定義された窒素( アペックス)およびその隣接原子です。 h に対応した強度のβ-ラクタム社より少ない数(平面より上のようなアミド)強化低反応性です。[7] Monobactamsて h の値の間には0.05-0.10 オングストローム (Å)です。 Cephemsて h 価値の0.20–0.25Åます。 Penamsての範囲の値に0.40–0.50Å、カルバペネム薬とclavamsて価値の0.50–0.60Åで、最も反応性のβが急務への加水分解します。[8]
その他の用途
新しい研究であるとの提案がなされるβが急務でを受ける開環 重合 を形成アミド債券、ナイロン-3ポリマーです。 のバックボーンのこれらの高分子されているものがあります。ペプチドを提供しbiofunctionalityます。 このナイロン-3高分子は生 体防御のペプチド または法として信号を刺激する 3T3 細胞 の機能です。[要出典]
参照
参考文献
- ^ Gilchrist, T. (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 0-582-01421-2
- ^ Brandt, C. (2017). “In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species”. SciRep 7 (43232). doi:10.1038/srep43232.
- ^ Ehmann, David E. (2012). “Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor”. PNAS 109 (29): 11663–11668. doi:10.1073/pnas.1205073109.
- ^ Tidwell, Thomas T. (2008). “Hugo (Ugo) Schiff, Schiff Bases, and a Century of β-Lactam Synthesis”. Angewandte Chemie International Edition 47 (6): 1016–20. doi:10.1002/anie.200702965. PMID 18022986.
- ^ Hermann Staudinger (1907). “Zur Kenntniss der Ketene. Diphenylketen”. Justus Liebigs Ann. Chem. 356 (1-2): 51–123. doi:10.1002/jlac.19073560106.
- ^ Flynn, E.H. (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press
- ^ Woodward, R.B. (1980). “Penems and related substances”. Phil Trans Royal Soc Chem B 289 (1036): 239–50. doi:10.1098/rstb.1980.0042. PMID 6109320.
- ^ Nangia, A. (1996). “Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study”. J Chem Soc, Perkin Trans 2 (5): 943–53. doi:10.1039/p29960000943.
- ^ O'Boyle, Niamh (December 2010). “Synthesis and Evaluation of Azetidinone Analogues of Combretastatin A-4 as Tubulin Targeting Agents”. Journal of Medicinal Chemistry 53 (24): 8569–8584. doi:10.1021/jm101115u. PMID 21080725.
- ^ O'Boyle, Niamh (2011). “Synthesis, evaluation and structural studies of antiproliferative tubulin-targeting azetidin-2-ones”. Bioorganic and Medicinal Chemistry 19 (7): 2306–2625. doi:10.1016/j.bmc.2011.02.022.