塩化ジルコニウム(IV)
塩化ジルコニウム(IV)(えんかジルコニウム、Zirconium(IV) chlorideまたはZirconium tetrachloride)は化学式ZrCl4であらわされる無機化合物である。昇華性の白色固体であり、湿った空気中では速やかに吸湿して加水分解する。他のジルコニウム化合物の重要な前駆体である。
| 塩化ジルコニウム(IV) | |
|---|---|
| |
| |

| |
Zirconium tetrachloride | |
| 識別情報 | |
| CAS登録番号 | 10026-11-6 |
| EC番号 | 233-058-2 |
| 特性 | |
| 化学式 | ZrCl4 |
| モル質量 | 233.04 g/mol |
| 外観 | 白色結晶 吸湿性 |
| 密度 | 2.80 g/cm3 |
| 融点 |
437 ℃(三重点) |
| 水への溶解度 | 加水分解 |
| 溶解度 | アルコール, エーテル, 濃塩酸 |
| 構造 | |
| 結晶構造 | 単斜晶系, mP10 |
| 空間群 | P12/c1, No. 13 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−980.52 kJ/mol |
| 標準モルエントロピー S |
181.41 J K−1 mol−1 |
| 危険性 | |
| 安全データシート(外部リンク) | MSDS |
| 引火点 | 不燃性 |
| 半数致死量 LD50 | 1688 mg/kg (oral, rat) |
| 関連する物質 | |
| その他の陰イオン | フッ化ジルコニウム(IV) 臭化ジルコニウム(IV) ヨウ化ジルコニウム(IV) |
| その他の陽イオン | 塩化チタン(IV) 塩化ハフニウム(IV) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
構造 編集
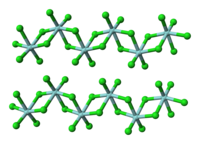
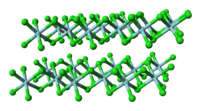
ジルコニウムと同族であるチタンの塩化物の塩化チタン(IV)とは異なり、固体の塩化ジルコニウム(IV)は各々のジルコニウムが八面体配位構造となるような重合構造を取る。この違いによって、塩化チタン(IV)が沸点136.4 ℃の液体であるのに対し塩化ジルコニウム(IV)は昇華性の固体であるような特性の差異が生じる。固体状態では塩化ジルコニウム(IV)は塩化ハフニウム(IV)と同様の線形重合構造をとる。この重合体はルイス塩基による処理によってCl-Zr-Cl結合が解離してすぐに開裂する[1]。
クロール法 編集
塩化ジルコニウム(IV)はクロール法によるジルコニウム鉱石から金属ジルコニウムを得る過程で現れる中間生成物である。全てのジルコニウム塩化物は加水分解を受けるため、自然な状態ではジルコニウムは常に酸化物として存在している。ジルコニウムをバルク金属として得るため、はじめに塩素および酸素ゲッターとしての炭素を酸化物と反応させ、精製しにくい酸化物を蒸留可能な塩化物にする。その後、塩化ジルコニウム(IV)を蒸留精製した後、過剰量の溶融マグネシウムと反応させて金属ジルコニウムが得られる。
反応 編集
塩化ジルコニウム(IV)の水和反応は塩化ジルコニル(en:Zirconyl chloride)とよばれる水和塩化水酸化ジルコニウムを与える。この反応は急速に進行する不可逆反応であり、ジルコニウム(IV)の高い親オキソ性(en:Oxophilicity)と一致している。したがって、塩化ジルコニウム(IV)を扱うには一般的に不活性ガス雰囲気等の空気のない環境が必要となる。
塩化ジルコニウム(IV)はアルミニウムなどによって還元され塩化ジルコニウム(III)を与える[2]。また、アンモニアを吸収してアンミン塩(ZrCl4・4NH3)を与え、五塩化リンとは複塩(ZrCl4・PCl5)を与える[3]。
塩化ジルコニウム(IV)は多くの有機ジルコニウム錯体合成のための出発物質である[4]。塩化ジルコニウム(IV)は重合構造を取っているため、反応の前処理としてテトラヒドロフランと1:2の錯体[注釈 1]を形成させ単分子体とする[5]。
ナトリウムシクロペンタジエニド(en:Sodium cyclopentadienide)と塩化ジルコニウム(IV)THF錯体とを反応させることで、シュワルツ試薬の合成原料など多くの用途に使われる有機ジルコニウム錯体である二塩化ジルコノセン(en:Zirconocene dichloride)が得られる[6]。
塩化ジルコニウム(IV)のもっとも奇妙な特性の一つは、デュレンのようなメチル化ベンゼンを添加することで通常では溶解しないハロゲン化溶媒に対する溶解性が著しく向上することである。この可溶化は、塩化ジルコニウム(IV)にη6型で配位したアレーン錯体(パイ錯体)の形成を通じて起こる[7]。
用途 編集
塩化ジルコニウム(IV)は有機合成においてフリーデル・クラフツ反応やディールス・アルダー反応、分子内環化反応の弱いルイス酸として用いられる[8]。また、織物の撥水剤にも用いられる。
脚注 編集
- ^ テトラクロロビス(テトラヒドロフラン)ジルコニウム CAS [21959-01-3]、mp 175-177 ℃ http://www.chemicalbook.com/ChemicalProductProperty_JP_CB3143720.htm 2010.11.6閲覧
出典 編集
- ^ N. N. Greenwood & A. Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, Oxford, 1997.
- ^ Ruff, Otto; Wallstein, Richard (1923). “Reduktion anorganischer Halogenide III.1) Die Reduktion des Zirkontetrachlorids”. Zeitschrift für anorganische und allgemeine Chemie 128: 96. doi:10.1002/zaac.19231280110.
- ^ 化学大辞典編集委員会(編)『化学大辞典1縮刷版第26版』共立(1981/10)、初版(1963/07)
- ^ New Aspects of Zirconium Containing Organic Compounds. Topics in Organometallic Chemistry, 10 Edited by Ilan Marek (Technion-Israel Institute of Technology, Haifa). Springer: Berlin, Heidelberg, New York. 2005. x + 176 pp. ISBN 3-540-22221-9.
- ^ L. E. Manxzer, Joe Deaton, Paul Sharp, R. R. Schrock (1982). “Tetrahydrofuran Complexes of Selected Early Transition Metals”. Inorganic Syntheses 21: 135–40. doi:10.1002/9780470132524.ch31.
- ^ G. Wilkinson and J.G. Birmingham (1954). “Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta”. J. Am. Chem. Soc. 76 (17): 4281–4284. doi:10.1021/ja01646a008.
- ^ Musso, F.; Solari, E.; Floriani, C.; Schenk, K. (1997). “Hydrocarbon Activation with Metal Halides: Zirconium Tetrachloride Catalyzing the Jacobsen Reaction and Assisting the Trimerization of Alkynes via the Formation of η6-Arene-Zirconium(IV) Complexes”. Organometallics 16: 4889–4895. doi:10.1021/om970438g.
- ^ Bora U. (2003). “Zirconium Tetrachloride”. Synlett: 1073–1074. doi:10.1055/s-2003-39323.