硫化カリウム
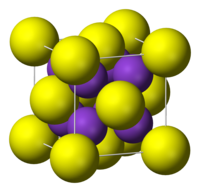
硫化カリウム(りゅうかカリウム potassium sulfide)は化学式K2Sで表される無機化合物。結晶構造は逆蛍石型で、小さなカリウムイオンK+による立方体の内部に、大きな硫化物イオンS2−が入り込む構造となっている[2]。その格子定数はa = 7.39Åである[3]。
| 硫化カリウム Potassium sulfide | |
|---|---|
| |
硫化カリウム | |
別称 チオジカリウム | |
| 識別情報 | |
| CAS登録番号 | 1312-73-8 |
| RTECS番号 | TT6000000 |
| 特性 | |
| 化学式 | K2S |
| モル質量 | 110.262 g/mol |
| 外観 | 白色の結晶。吸湿したものは赤色または茶色。 |
| 密度 | 1.805 g/cm3(14℃) |
| 融点 |
840 ℃ |
| 沸点 |
分解 |
| 水への溶解度 | 硫化水素カリウム、水酸化カリウムに分解。 |
| その他の溶剤への溶解度 | エタノールやグリセリンに可溶 |
| 構造 | |
| 結晶構造 | 逆蛍石型 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−380.7 kJ mol−1[1] |
| 標準モルエントロピー S |
105 J mol−1K−1 |
| 危険性 | |
| 主な危険性 | 腐食性(C) 環境への危険性 (N) |
| Rフレーズ | R31, R34, R50 |
| Sフレーズ | (S1/2), S26, S45, S61 |
| 関連する物質 | |
| 関連物質 | 硫化ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫化物イオンは電荷密度の高い陰イオンであり、加水分解により水酸化カリウムと硫化水素カリウムに分解される。このため水溶液は強アルカリ性を示す。
用途 編集
花火の火薬として直接使用されてはいないものの燃焼中に生成し、花火の発色に効果を表す[4]。ほかのアルカリ金属の硫化物と同様、硫化物イオンの供給源として用いられ[2]、医薬品の中間原料や分析試薬としても使用される。
安全性 編集
引火性があり、空気との接触により自然発火することがある。燃焼により硫化水素や硫黄酸化物を含む有毒ガスが生じる。摩擦や衝撃により、爆発的に分解する場合がある。酸との接触により分解し、硫化水素が発生する。酸化剤との接触では二酸化硫黄が生じる。空気中の酸素や二酸化炭素と反応し、徐々に硫化水素を放つ。吸入により、肺水腫を引き起こすことがある[5][6]。
脚注 編集
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ a b Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ 『化学大辞典』 共立出版、1993年
- ^ Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications: Austin, 1981. ISBN 0-929388-05-4.
- ^ 国際化学物質安全性カード
- ^ 製品安全データシート(安全衛生情報センター)
