細胞膜ナノチューブ
細胞膜ナノチューブ(Membrane nanotube)は、細胞膜から突出する長くて細い管で、異なる動物細胞を接続する。トンネルナノチューブ(Tunneling nanotube、TNT)とも呼ばれる。この構造は非常に長くなることがあり、100 μm以上離れたT細胞間の接続を行うこともある[2][3][4]。2種類のタイプの構造がナノチューブと呼ばれている。1つは直径が 0.7 μm以下のものでアクチンのみを含み、細胞間で細胞膜の一部を双方向に輸送する。もう1つは直径 0.7 μm以上のものでアクチンと微小管の双方を含み、小胞やミトコンドリアを含む細胞小器官など、細胞質の構成要素が細胞間で輸送されることもある[5][6]。これらの構造は、細胞間コミュニケーション[7]、核酸の移動[8]、HIV[3]やプリオン[9]のような病原体の拡散に関わっていると考えられている。こうした構造の持続時間は数分から数時間であることが観察されており[10]、いくつかのタンパク質が形成と阻害に関与している。
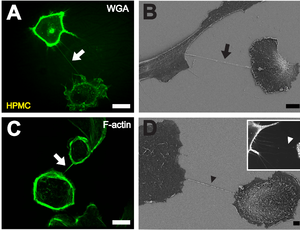
B 播種1時間後に2つ細胞間に形成されたTNT。走査型電子顕微鏡像。スケールバー:10 μm。
C 蛍光ラベルされたファロイジンによるアクチン繊維の染色。スケールバー:20 μm。
D TNTの前駆体となる可能性のある、フィロポディア様の伸長構造(黒い矢じり)の走査型電子顕微鏡像。インサート部分では、近隣細胞へ接近しているフィロポディア様突起(白い矢じり)の蛍光顕微鏡像が示されている。スケールバー:2 μm。[1]
歴史 編集
この構造に初めて言及したのは1999年にセル誌に掲載された論文で、キイロショウジョウバエの羽の成虫原基の発生について研究したものであった[11]。また、2004年にサイエンス誌に掲載された論文では、さまざまな種類の免疫細胞や、培養組織中の細胞どうしを連結している構造について記載された[6][12]。それ以降、さまざまなレベルのアクチン繊維、微小管や他の構成要素を含むTNT類似構造が多く記録されているが、組成という観点からは比較的均質である[10]。
形成 編集
ナノチューブの形成には、分子的制御や細胞間相互作用など、いくつかの機構が関与している可能性がある。
TNTの形成には2つの主要な機構が提唱されている。1つは、細胞質の突起が一方の細胞から伸長し、標的細胞の膜と融合するというものである[6]。もう1つは、2つの連結された細胞が互いに離れて移動し、TNTが2つの細胞間のブリッジとして残るというものである[3][13]。
誘導 編集
一部の樹状細胞とTHP-1単球では、トンネルナノチューブによる連結が存在すること、そして細菌や機械的な刺激にさらされた際に細胞間でカルシウムの流れが生じることが示されている。樹状細胞が細菌産物にさらされた際に形成されるラメリポディアと同様に、TNTを介したシグナル伝達によって標的細胞へシグナルが拡散されることが示されている。この研究では、TNTは 35 μm/sの初速で伝播を行うこと、THP-1単球は最大 100 μmの長さのナノチューブで連結されていることが示された[14]。
サイトネーム(サイトニーム、 cytoneme)はBnL-FGFの勾配に従って形成されることが観察されており、走化性による制御がTNT様構造の形成を誘導している可能性が示唆されている[11]。ホスファチジルセリンの露出が間葉系幹細胞から損傷細胞集団へのTNTの成長方向のガイドとなることも、このことを支持している[15]。タンパク質S100A4とその受容体はTNTの成長方向のガイドとなることが示されている。p53はカスパーゼ-3を活性化してS100A4を切断し、標的細胞でタンパク質が多く存在するような勾配を形成する[16]。
ある研究では、T細胞間のナノチューブの形成には細胞間の接触が必要であることが発見されている[3]。p53の活性化もTNTの形成に必要な機構であることが示唆されており、p53によってアップレギュレーションされる下流遺伝子(すなわちEGFR、Akt、PI3K、mTOR)は過酸化水素処理と血清枯渇後のナノチューブの形成に関与することが判明している[17]。コネキシン43は骨髄由来間質細胞と肺胞上皮細胞間の連結を促進し、ナノチューブの形成をもたらすことが示されている[18]。
ロテノンによる細胞ストレスやTNF-αも上皮細胞間のTNTの形成を誘導することが示されている[19]。リポ多糖やインターフェロンγによる炎症は、TNT形成に関連するタンパク質の発現を上昇させることが示されている[20]。
阻害 編集
Streamerと呼ばれるTNT様構造は、F-アクチン脱重合化合物であるサイトカラシンD存在下で培養されたときには形成されず[21]、また他の研究ではサイトカラシンBは既存のTNTを破壊することなく、TNTの形成に影響を与えることが示されている[22]。他のF-アクチン脱重合化合物であるラトランクリンBは、TNTの形成を完全に防ぐことが示されている[6]。アストロサイトによるミトコンドリアの移行への関与が示唆されているCD38[23]をノックダウンすることで、TNTの形成は大きく減少する[24]。
TNFAIP2はM-Secとも呼ばれ、TNTの形成を媒介することが知られている。このタンパク質をshRNAでノックダウンすることにより、上皮細胞におけるTNTの発生は約1/3に減少する[20]。
ミトコンドリアの移行における役割 編集
トンネルナノチューブは、ミトコンドリアが細胞間を移行する機構の1つとして示唆されている[6]。ミトコンドリアDNAの損傷がミトコンドリアの移行のためのTNT形成の主なトリガーであるようであるが[25]、TNTの形成の誘導に必要な損傷の正確な閾値は未解明である。ミトコンドリアがTNTを移動する最大速度は約 80 nm/sであり、ミトコンドリアの軸索輸送時の 100–1400 nm/sよりも低い。これはTNTの小さな直径がミトコンドリアの移動を妨げているためである可能性がある[26]。
ある研究では、異なる表現型のRhoファミリーGTPアーゼMiro1を発現する4つの間葉系幹細胞株を用いることで、Miro1の発現レベルの高さがTNTを介したミトコンドリア移行の効率の高さと関係していることが示された[19]。TNTの形成を選択的に防ぐ実験からは、TNTが異なる細胞種間でのミトコンドリア移動の主要な機構であることが示されている[27][28][29]。
類似の構造 編集
サイトネームと呼ばれる構造はショウジョウバエの羽の成虫原基の交換を可能にする。しかし、サイトネームは常に2つの細胞を連結しているわけではなく、環境のセンサーとしてのみ機能している場合もある[21]。
似たような構造で、原形質連絡と呼ばれるものは植物細胞間[30]、ストロミュールは色素体間[31]の連結を行っている。
Myopodiaは、ショウジョウバエの胚で観察される、アクチンに富む細胞質の突起である。類似した構造はツメガエルXenopusとマウスでも観察されている[10]。Streamerと呼ばれるアクチンを含む細胞突起が培養B細胞で観察される[21]。
また、細胞膜ナノチューブによる小胞輸送が量子ドットによりモデル化されている[32]。環状ペプチドや他の環状分子のスタッキングによる、さまざまな合成ナノチューブの研究が行われている[33]。
出典 編集
- ^ Bereswill, Stefan, ed (2011-12-27). “Nanotube action between human mesothelial cells reveals novel aspects of inflammatory responses”. PLOS ONE 6 (12): e29537. Bibcode: 2011PLoSO...629537R. doi:10.1371/journal.pone.0029537. PMC 3246504. PMID 22216308.
- ^ “Wiring through tunneling nanotubes--from electrical signals to organelle transfer”. Journal of Cell Science 125 (Pt 5): 1089–98. (March 2012). doi:10.1242/jcs.083279. PMID 22399801.
- ^ a b c d “Membrane nanotubes physically connect T cells over long distances presenting a novel route for HIV-1 transmission”. Nature Cell Biology 10 (2): 211–9. (February 2008). doi:10.1038/ncb1682. PMID 18193035.
- ^ Davis DM, Sowinski S (June 2008). “Membrane nanotubes: dynamic long-distance connections between animal cells”. Nat. Rev. Mol. Cell Biol. 9 (6): 431–6. doi:10.1038/nrm2399. PMID 18431401.
- ^ Onfelt B, Nedvetzki S, Benninger RK et al. (December 2006). “Structurally distinct membrane nanotubes between human macrophages support long-distance vesicular traffic or surfing of bacteria”. J. Immunol. 177 (12): 8476–83. doi:10.4049/jimmunol.177.12.8476. PMID 17142745.
- ^ a b c d e “Nanotubular highways for intercellular organelle transport”. Science 303 (5660): 1007–10. (February 2004). Bibcode: 2004Sci...303.1007R. doi:10.1126/science.1093133. PMID 14963329.
- ^ Onfelt B, Davis DM (November 2004). “Can membrane nanotubes facilitate communication between immune cells?”. Biochem. Soc. Trans. 32 (Pt 5): 676–8. doi:10.1042/BST0320676. PMID 15493985.
- ^ Belting M, Wittrup A (December 2008). “Nanotubes, exosomes, and nucleic acid–binding peptides provide novel mechanisms of intercellular communication in eukaryotic cells: implications in health and disease”. J. Cell Biol. 183 (7): 1187–91. doi:10.1083/jcb.200810038. PMC 2606965. PMID 19103810.
- ^ Gousset K, Schiff E, Langevin C et al. (February 2009). “Prions hijack tunnelling nanotubes for intercellular spread”. Nat. Cell Biol. 11 (3): 328–36. doi:10.1038/ncb1841. PMID 19198598.
- ^ a b c “The art of cellular communication: tunneling nanotubes bridge the divide”. Histochemistry and Cell Biology 129 (5): 539–50. (May 2008). doi:10.1007/s00418-008-0412-0. PMC 2323029. PMID 18386044.
- ^ a b Ramírez-Weber FA, Kornberg TB (May 1999). “Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs”. Cell 97 (5): 599–607. doi:10.1016/S0092-8674(00)80771-0. PMID 10367889.
- ^ Onfelt B, Nedvetzki S, Yanagi K, Davis DM (1 August 2004). “Cutting edge: Membrane nanotubes connect immune cells”. J. Immunol. 173 (3): 1511–3. doi:10.4049/jimmunol.173.3.1511. PMID 15265877.
- ^ “Retroviruses can establish filopodial bridges for efficient cell-to-cell transmission”. Nature Cell Biology 9 (3): 310–5. (March 2007). doi:10.1038/ncb1544. PMC 2628976. PMID 17293854.
- ^ “Functional connectivity between immune cells mediated by tunneling nanotubules”. Immunity 23 (3): 309–18. (September 2005). doi:10.1016/j.immuni.2005.08.009. PMID 16169503.
- ^ “Mesenchymal stem cells rescue injured endothelial cells in an in vitro ischemia-reperfusion model via tunneling nanotube like structure-mediated mitochondrial transfer”. Microvascular Research 92: 10–8. (March 2014). doi:10.1016/j.mvr.2014.01.008. PMID 24486322.
- ^ “Tunneling-nanotube direction determination in neurons and astrocytes”. Cell Death & Disease 3 (12): e438. (December 2012). doi:10.1038/cddis.2012.177. PMC 3542613. PMID 23222508.
- ^ “Tunneling-nanotube development in astrocytes depends on p53 activation”. Cell Death and Differentiation 18 (4): 732–42. (April 2011). doi:10.1038/cdd.2010.147. PMC 3131904. PMID 21113142.
- ^ “Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury”. Nature Medicine 18 (5): 759–65. (April 2012). doi:10.1038/nm.2736. PMC 3727429. PMID 22504485.
- ^ a b “Miro1 regulates intercellular mitochondrial transport & enhances mesenchymal stem cell rescue efficacy”. The EMBO Journal 33 (9): 994–1010. (May 2014). doi:10.1002/embj.201386030. PMC 4193933. PMID 24431222.
- ^ a b “M-Sec promotes membrane nanotube formation by interacting with Ral and the exocyst complex”. Nature Cell Biology 11 (12): 1427–32. (December 2009). doi:10.1038/ncb1990. PMID 19935652.
- ^ a b c “Tunneling nanotubes: Diversity in morphology and structure”. Communicative & Integrative Biology 7 (1): e27934. (January 2014). doi:10.4161/cib.27934. PMC 3995728. PMID 24778759.
- ^ “Selective block of tunneling nanotube (TNT) formation inhibits intercellular organelle transfer between PC12 cells”. FEBS Letters 583 (9): 1481–8. (May 2009). doi:10.1016/j.febslet.2009.03.065. PMID 19345217.
- ^ “Transfer of mitochondria from astrocytes to neurons after stroke”. Nature 535 (7613): 551–5. (July 2016). Bibcode: 2016Natur.535..551H. doi:10.1038/nature18928. PMC 4968589. PMID 27466127.
- ^ “CD38-Driven Mitochondrial Trafficking Promotes Bioenergetic Plasticity in Multiple Myeloma”. Cancer Research 79 (9): 2285–2297. (May 2019). doi:10.1158/0008-5472.CAN-18-0773. PMID 30622116.
- ^ “Mitochondria Know No Boundaries: Mechanisms and Functions of Intercellular Mitochondrial Transfer”. Frontiers in Cell and Developmental Biology 4: 107. (2016). doi:10.3389/fcell.2016.00107. PMC 5039171. PMID 27734015.
- ^ “Transfer of mitochondria via tunneling nanotubes rescues apoptotic PC12 cells”. Cell Death and Differentiation 22 (7): 1181–91. (July 2015). doi:10.1038/cdd.2014.211. PMC 4572865. PMID 25571977.
- ^ “Preferential transfer of mitochondria from endothelial to cancer cells through tunneling nanotubes modulates chemoresistance”. Journal of Translational Medicine 11 (1): 94. (April 2013). doi:10.1186/1479-5876-11-94. PMC 3668949. PMID 23574623.
- ^ “Tunneling nanotubes promote intercellular mitochondria transfer followed by increased invasiveness in bladder cancer cells”. Oncotarget 8 (9): 15539–15552. (February 2017). doi:10.18632/oncotarget.14695. PMC 5362504. PMID 28107184.
- ^ “Mitochondrial transfer of induced pluripotent stem cell-derived mesenchymal stem cells to airway epithelial cells attenuates cigarette smoke-induced damage”. American Journal of Respiratory Cell and Molecular Biology 51 (3): 455–65. (September 2014). doi:10.1165/rcmb.2013-0529OC. PMID 24738760.
- ^ Gallagher KL, Benfey PN (January 2005). “Not just another hole in the wall: understanding intercellular protein trafficking”. Genes Dev. 19 (2): 189–95. doi:10.1101/gad.1271005. PMID 15655108.
- ^ Köhler RH, Cao J, Zipfel WR, Webb WW, Hanson MR (1997). “Exchange of protein molecules through connections between higher plant plastids”. Science 276: 1039–1042. doi:10.1126/science.276.5321.2039. PMID 9197266.
- ^ Kuznetsov, A.V. (2011). “Modeling bidirectional transport of quantum dot nanoparticles in membrane nanotubes”. Mathematical Biosciences 232 (2): 101–109. doi:10.1016/j.mbs.2011.04.008.
- ^ Rodríguez-Vázquez, Nuria; Fuertes, Alberto; Amorín, Manuel; Granja, Juan R. (2016). “Chapter 14. Bioinspired Artificial Sodium and Potassium Ion Channels”. In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel. The Alkali Metal Ions: Their Role in Life. Metal Ions in Life Sciences. 16. Springer. pp. 485–556. doi:10.1007/978-4-319-21756-7_14
関連文献 編集
- “The art of cellular communication: tunneling nanotubes bridge the divide”. Histochemistry and Cell Biology 129 (5): 539–50. (May 2008). doi:10.1007/s00418-008-0412-0. PMC 2323029. PMID 18386044.
- “Tunnelling nanotubes: Life's secret network”. New Scientist. (November 2008).
関連項目 編集
外部リンク 編集
- Hans-Hermann Gerdes Research Group - 細胞膜ナノチューブを最初に発見した研究室