RAD52
RAD52は、ヒトではRAD52遺伝子によってコードされるタンパク質である[5][6]。
機能 編集
RAD52遺伝子にコードされるRAD52タンパク質には、DNA二本鎖切断修復と相同組換えに重要な、出芽酵母Saccharomyces cerevisiaeのRad52タンパク質との類似性がみられる。RAD52は一本鎖DNA末端に結合し、相補的なDNA鎖間のアニーリングに必要なDNA-DNA間相互作用を媒介することが示されている。また、DNA組換えタンパク質RAD51と相互作用することも知られており、RAD51と関連したDNAの組換えと修復に関与することが示唆されている[6]。
DNA組換え修復における役割 編集
RAD52は、出芽酵母と哺乳類細胞(マウスとヒト)の双方において、相同組換え修復(HRR)におけるRAD51の機能を媒介する。しかしながら、RAD52のHRRにおける機能は、酵母とヒトでは異なる。出芽酵母ではRad52タンパク質は単独で作用し、組換えの対合前の段階で既にRPAで覆われた一本鎖DNAへRad51タンパク質をロードする役割を果たす[7][8]。
一方マウスとヒトでは、主にBRCA2が一本鎖DNA上でのRAD51の規則的な組み立てを媒介し、相同鎖の対合と鎖の侵入(strand invasion)の活性を有する形態が形成される[9]。また、BRCA2はRAD51のdsDNAへの結合を低下させ、またssDNAからの解離を防ぐ[9]。さらに、RAD51の4つのパラログ、RAD51B(RAD51L1)、RAD51C(RAD51L2)、RAD51D(RAD51L3)、XRCC2はBCDX2複合体と呼ばれる複合体を形成する。この複合体はRAD51の損傷部位へのリクルートと安定化に関与し[10]、RAD51ヌクレオタンパク質フィラメントの組み立てまたは安定性を促進する作用を果たしているようである。しかしながら、BRCA2に変異が存在する場合には、ヒトのRAD52は一本鎖DNA上でのRAD51の組み立てを媒介することができ、より低効率であるものの、相同組換えによるDNA修復におけるBRCA2の代替として機能することができる[11]。
さらに、ヒトのRAD52はERCC1とともに、エラーが起こりやすい相同組換え経路であるSSA(single-strand annealing)経路を促進する[12]。この修復経路はエラーが起こりやすいものの、それ以外の方法では修復できないDNA損傷を抱えた細胞の生存には必要である可能性がある。
ヒトのRAD52は、細胞周期のG0/G1期の活発な転写部位でのDNA二本鎖切断修復に重要な役割を果たす。こうした二本鎖切断の修復においては、RAD52に依存した、RNA鋳型を用いた組換え機構が利用されているようである[13]。ERCC6遺伝子にコードされるコケイン症候群Bタンパク質(CSB)は活発な転写部位の二本鎖切断に局在し、続いてRAD51、RAD51CとRAD52が新たに合成されたRNAを鋳型として相同組換え修復を行う[13]。
miRNAとがんのリスク 編集
mRNAの3' UTRには、転写後段階でのRNAサイレンシングを引き起こす調節配列が含まれていることが多い。こうした3' UTRには多くの場合、miRNAの結合部位が含まれている。miRNAは3' UTR内の特定の部位に結合することで、翻訳の阻害または転写産物の分解によってさまざまなmRNAからの遺伝子発現を減少させる。
miRNAはヒトゲノム中のタンパク質コード遺伝子の60%以上の発現を調節しているようである[14]。そうしたmiRNAの1つ、miR-270はRAD52を抑制する[15]。miR-210は大部分の固形腫瘍でアップレギュレーションされており、臨床転帰に負の影響を与える[16]。
RAD52のmRNAの3' UTRには、let-7の結合部位も存在する。let-7の結合を減少させるSNP(rs7963551)を持つ女性は、RAD52の発現が上昇している可能性が高い(このことは肝臓で示されている[17])。このSNPを持つ女性は乳がんのリスクが低いことが示されている(オッズ比[OR] 0.84、95%信頼区間[CI] 0.75–0.95)[18]。
漢族では、このSNPが神経膠腫のリスクを低下させることが示されている。RAD52 rs7963551遺伝子型と関係した神経膠腫のリスクは42歳以上の場合OR 0.44、41歳以下の場合OR 0.58である[19]。
中国人集団では、RAD52 rs7963551 CC遺伝子型(上述したものと同じ)の肝細胞がんのリスクはAA遺伝子型と比較して有意に低い。また、44種類の正常なヒト肝組織試料を解析した結果、rs7963551 SNPを持つヒトの試料ではRAD52のmRNAの発現が有意に高かった[17]。
このように、RAD52の発現の増加はさまざまながんに対する保護機能となっている。
RAD52のmRNA中のmiRNA結合部位の変化とがん感受性への影響を調べる他の研究も行われている[20]。そこでは、高頻度で変化している2つのmiRNA結合部位が結腸がんのリスクに影響していることが発見された。rs1051669 SNPをホモ接合型またはヘテロ接合型で持っている場合、結腸がんのリスクが高まる(ホモ接合型: OR 1.78, 95% CI 1.13–2.80, p = 0.01; ヘテロ接合型: OR 1.72, 95% CI 1.10–2.692, p = 0.02)。他のSNP(rs11571475)をヘテロ接合型で保有している場合、結腸がんのリスクは低くなる(OR 0.76, 95% CI 0.58–1.00, p = 0.05)。調査が行われた相同組換え修復経路に関与する遺伝子21種類と非相同末端結合経路に関与する遺伝子7種類のうち、評価可能な頻度で変化し、かつ結腸がんのリスクに影響を与えるmiRNA結合部位のSNPが観察されたのは、RAD52の2か所とMRE11Aの1か所のみであった。
DNA損傷はがんの主要な根本要因であるようであり[21]、多くの種類のがんの根底にはDNA修復の欠乏があるようである[22]。DNA修復が欠乏している場合、DNA損傷は蓄積する傾向がある。こうした過剰なDNA損傷は、DNA複製時に損傷乗り越え合成(translesion synthesis)が行われることでエラーの増加をもたらしている可能性がある。また、過剰なDNA損傷はDNA修復時のエラーに伴うエピジェネティックな変化を増加させている可能性もあり[23][24]、こうした変異やエピジェネティックな変化ががんを生じさせている可能性がある。miRNAの結合の変化によるRAD52を介したDNA修復の頻繁な増加または欠乏は、乳がん、脳腫瘍、肝臓がん、大腸がんの予防または進行のいずれかに寄与している可能性が高い。
相互作用 編集
RAD52はRAD51と相互作用することが示されている[25]。
遺伝子内相補性 編集
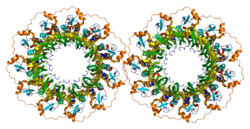
1つの遺伝子にコードされるポリペプチドが複数コピー集まって凝集体を形成するとき、こうしたタンパク質構造はマルチマー(multimer)と呼ばれる。特定の遺伝子の2つの異なる変異体アレルから産生されるポリペプチドによってマルチマーが形成される場合、こうした混合型マルチマーは各変異体アレル単独から形成される非混合型マルチマーよりも高い機能的活性を示す可能性がある。この現象は遺伝子内相補性(intragenic complementation)と呼ばれる。出芽酵母では、C末端短縮型タンパク質を発現するRAD52変異体アレルが他のミスセンス変異体アレルを相補することが発見されている[26]。こうした遺伝子内相補性の存在は、RAD52タンパク質が単量体間の協同的相互作用を可能にするようなマルチマー構造を持つことを示唆している。
出典 編集
- ^ a b c GRCh38: Ensembl release 89: ENSG00000002016 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000030166 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “The human and mouse homologs of the yeast RAD52 gene: cDNA cloning, sequence analysis, assignment to human chromosome 12p12.2-p13, and mRNA expression in mouse tissues”. Genomics 25 (1): 199–206. (Jan 1995). doi:10.1016/0888-7543(95)80126-7. PMID 7774919.
- ^ a b “Entrez Gene: RAD52 RAD52 homolog (S. cerevisiae)”. 2022年6月17日閲覧。
- ^ “Stimulation by Rad52 of yeast Rad51-mediated recombination”. Nature 391 (6665): 404–7. (1998). doi:10.1038/34943. PMID 9450759.
- ^ “Rad52 protein stimulates DNA strand exchange by Rad51 and replication protein A”. Nature 391 (6665): 407–10. (1998). doi:10.1038/34950. PMID 9450760.
- ^ a b “Unraveling the mechanism of BRCA2 in homologous recombination”. Nat. Struct. Mol. Biol. 18 (7): 748–54. (2011). doi:10.1038/nsmb.2096. PMC 3647347. PMID 21731065.
- ^ “Rad51 paralog complexes BCDX2 and CX3 act at different stages in the BRCA1-BRCA2-dependent homologous recombination pathway”. Mol. Cell. Biol. 33 (2): 387–95. (2013). doi:10.1128/MCB.00465-12. PMC 3554112. PMID 23149936.
- ^ “Rad52 inactivation is synthetically lethal with BRCA2 deficiency”. Proc. Natl. Acad. Sci. U.S.A. 108 (2): 686–91. (2011). doi:10.1073/pnas.1010959107. PMC 3021033. PMID 21148102.
- ^ “Genetic steps of mammalian homologous repair with distinct mutagenic consequences”. Mol. Cell. Biol. 24 (21): 9305–16. (2004). doi:10.1128/MCB.24.21.9305-9316.2004. PMC 522275. PMID 15485900.
- ^ a b “DNA damage during the G0/G1 phase triggers RNA-templated, Cockayne syndrome B-dependent homologous recombination”. Proc. Natl. Acad. Sci. U.S.A. 112 (27): E3495–504. (2015). doi:10.1073/pnas.1507105112. PMC 4500203. PMID 26100862.
- ^ “Most mammalian mRNAs are conserved targets of microRNAs”. Genome Res. 19 (1): 92–105. (2009). doi:10.1101/gr.082701.108. PMC 2612969. PMID 18955434.
- ^ “MicroRNA regulation of DNA repair gene expression in hypoxic stress”. Cancer Res. 69 (3): 1221–9. (2009). doi:10.1158/0008-5472.CAN-08-2516. PMC 2997438. PMID 19141645.
- ^ “miR-210: More than a silent player in hypoxia”. IUBMB Life 63 (2): 94–100. (2011). doi:10.1002/iub.427. PMC 4497508. PMID 21360638.
- ^ a b “Association of a functional RAD52 genetic variant locating in a miRNA binding site with risk of HBV-related hepatocellular carcinoma”. Mol. Carcinog. 54 (9): 853–8. (2015). doi:10.1002/mc.22156. PMID 24729511.
- ^ “Genetic variation in a hsa-let-7 binding site in RAD52 is associated with breast cancer susceptibility”. Carcinogenesis 34 (3): 689–93. (2013). doi:10.1093/carcin/bgs373. PMID 23188672.
- ^ “A RAD52 genetic variant located in a miRNA binding site is associated with glioma risk in Han Chinese”. J. Neurooncol. 120 (1): 11–7. (2014). doi:10.1007/s11060-014-1527-x. PMID 25012956.
- ^ “Double-strand break repair and colorectal cancer: gene variants within 3' UTRs and microRNAs binding as modulators of cancer risk and clinical outcome”. Oncotarget 7 (17): 23156–69. (2015). doi:10.18632/oncotarget.6804. PMC 5029617. PMID 26735576.
- ^ “DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture”. Mol. Cancer Res. 6 (4): 517–24. (2008). doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
- ^ “The DNA damage response: ten years after”. Mol. Cell 28 (5): 739–45. (2007). doi:10.1016/j.molcel.2007.11.015. PMID 18082599.
- ^ “Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island”. PLOS Genetics 4 (8): e1000155. (2008). doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
- ^ “DNA damage, homology-directed repair, and DNA methylation”. PLOS Genetics 3 (7): e110. (Jul 2007). doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
- ^ “Radiation-induced assembly of Rad51 and Rad52 recombination complex requires ATM and c-Abl”. The Journal of Biological Chemistry 274 (18): 12748–52. (Apr 1999). doi:10.1074/jbc.274.18.12748. PMID 10212258.
- ^ Boundy-Mills, K. L.; Livingston, D. M. (1993-01). “A Saccharomyces cerevisiae RAD52 allele expressing a C-terminal truncation protein: activities and intragenic complementation of missense mutations”. Genetics 133 (1): 39–49. doi:10.1093/genetics/133.1.39. ISSN 0016-6731. PMC 1205296. PMID 8417987.
関連文献 編集
- “Cloning of human and mouse genes homologous to RAD52, a yeast gene involved in DNA repair and recombination”. Mutation Research 315 (3): 295–305. (Nov 1994). doi:10.1016/0921-8777(94)90040-x. hdl:1765/3072. PMID 7526206.
- “The human and mouse homologs of the yeast RAD52 gene: cDNA cloning, sequence analysis, assignment to human chromosome 12p12.2-p13, and mRNA expression in mouse tissues”. Genomics 25 (1): 199–206. (Jan 1995). doi:10.1016/0888-7543(95)80126-7. PMID 7774919.
- “Expression of human RAD52 confers resistance to ionizing radiation in mammalian cells”. The Journal of Biological Chemistry 270 (26): 15467–70. (Jun 1995). doi:10.1074/jbc.270.26.15467. PMID 7797537.
- “UBL1, a human ubiquitin-like protein associating with human RAD51/RAD52 proteins”. Genomics 36 (2): 271–9. (Sep 1996). doi:10.1006/geno.1996.0462. PMID 8812453.
- “Associations of UBE2I with RAD52, UBL1, p53, and RAD51 proteins in a yeast two-hybrid system”. Genomics 37 (2): 183–6. (Oct 1996). doi:10.1006/geno.1996.0540. PMID 8921390.
- “Radiation-induced assembly of Rad51 and Rad52 recombination complex requires ATM and c-Abl”. The Journal of Biological Chemistry 274 (18): 12748–52. (Apr 1999). doi:10.1074/jbc.274.18.12748. PMID 10212258.
- “Identification of novel isoforms of human RAD52”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1489 (2–3): 303–14. (Dec 1999). doi:10.1016/s0167-4781(99)00214-6. PMID 10673031.
- “The human Rad52 protein exists as a heptameric ring”. Current Biology 10 (6): 337–40. (Mar 2000). doi:10.1016/S0960-9822(00)00385-7. PMID 10744977.
- “Precise binding of single-stranded DNA termini by human RAD52 protein”. The EMBO Journal 19 (15): 4175–81. (Aug 2000). doi:10.1093/emboj/19.15.4175. PMC 306603. PMID 10921897.
- “Structural basis for the recognition of DNA repair proteins UNG2, XPA, and RAD52 by replication factor RPA”. Cell 103 (3): 449–56. (Oct 2000). doi:10.1016/S0092-8674(00)00136-7. PMID 11081631.
- “Human RAD52 protein has extreme thermal stability”. Biochemistry 40 (29): 8557–62. (Jul 2001). doi:10.1021/bi0155089. PMID 11456495.
- “Visualization of recombination intermediates produced by RAD52-mediated single-strand annealing”. EMBO Reports 2 (10): 905–9. (Oct 2001). doi:10.1093/embo-reports/kve201. PMC 1084079. PMID 11571269.
- “Overexpression of human RAD51 and RAD52 reduces double-strand break-induced homologous recombination in mammalian cells”. Nucleic Acids Research 29 (21): 4352–60. (Nov 2001). doi:10.1093/nar/29.21.4352. PMC 60192. PMID 11691922.
- “Differential effects of Rad52p overexpression on gene targeting and extrachromosomal homologous recombination in a human cell line”. Nucleic Acids Research 30 (3): 740–8. (Feb 2002). doi:10.1093/nar/30.3.740. PMC 100286. PMID 11809887.
- “Analysis of the human replication protein A:Rad52 complex: evidence for crosstalk between RPA32, RPA70, Rad52 and DNA”. Journal of Molecular Biology 321 (1): 133–48. (Aug 2002). doi:10.1016/S0022-2836(02)00541-7. PMID 12139939.
- “Crystal structure of the homologous-pairing domain from the human Rad52 recombinase in the undecameric form”. Molecular Cell 10 (2): 359–71. (Aug 2002). doi:10.1016/S1097-2765(02)00587-7. PMID 12191481.
- “Structure of the single-strand annealing domain of human RAD52 protein”. Proceedings of the National Academy of Sciences of the United States of America 99 (21): 13492–7. (Oct 2002). doi:10.1073/pnas.212449899. PMC 129701. PMID 12370410.
- “Association of human RAD52 protein with transcription factors”. Biochemical and Biophysical Research Communications 297 (5): 1191–6. (Oct 2002). doi:10.1016/S0006-291X(02)02353-7. PMID 12372413.
- “No association between a stop codon polymorphism in RAD52 and breast cancer risk”. Cancer Epidemiology, Biomarkers & Prevention 11 (10 Pt 1): 1138–9. (Oct 2002). PMID 12376524.
- “Regulation of ionizing radiation-induced Rad52 nuclear foci formation by c-Abl-mediated phosphorylation”. The Journal of Biological Chemistry 277 (50): 48944–8. (Dec 2002). doi:10.1074/jbc.M208151200. PMID 12379650.