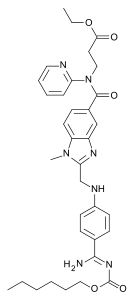
ダビガトラン
ダビガトランエテキシラート(Dabigatran etexilate)は、直接トロンビン阻害剤に属する経口抗凝固薬である。商品名プラザキサ。ワルファリンのように使用中にプロトロンビン時間(INR)を測定して用量調節する必要がない。大出血が発生した際にワルファリンの効果を打ち消す薬剤は存在する[2]が、ダビガトランの効果を打ち消す薬剤は2019年2月現在存在しない[3][4]。解毒剤としてイダルシズマブの臨床試験が実施されている[5][6][7]。
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Pradaxa, Pradax, Prazaxa |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | oral |
| 薬物動態データ | |
| 生物学的利用能 | 3–7%[1] |
| 血漿タンパク結合 | 35%[1] |
| 半減期 | 12–17 hours[1] |
| 識別 | |
| CAS番号 |
211915-06-9 |
| ATCコード | B01AE07 (WHO) |
| PubChem | CID: 6445226 |
| DrugBank | DB06695en:Template:drugbankcite |
| ChemSpider |
4948999 |
| KEGG | D09707 |
| ChEMBL | CHEMBL539697en:Template:ebicite |
| 化学的データ | |
| 化学式 | C34H41N7O5 |
| 分子量 | 627.734 g/mol |
| |
効能・効果 編集
日本での効能・効果は、「非弁膜症性心房細動患者における虚血性脳卒中および全身性塞栓症の発症抑制」である[8]。海外では非経口的に5〜10日間の低分子ヘパリン投与を受けた後の患者の深部静脈血栓症(DVT)や肺塞栓症(PE)の治療や予防にも使用される[9]。
非弁膜症性心房細動患者での虚血性脳卒中および全身性塞栓症の発症抑制効果はワルファリンより優れていると考えられる[10]。
禁忌 編集
ダビガトランは下記の患者には禁忌である[8]。
- 過敏症の既往歴のある患者
- 高度の腎障害(クレアチニンクリアランス30mL/min未満)のある患者
- 出血症状のある患者
- 出血性素因または止血障害のある患者
- 臨床的に問題となる出血リスクのある器質的病変[注 1]の患者
- 脊椎・硬膜外カテーテル留置患者および抜去後1時間以内の患者
- イトラコナゾールを経口投与中の患者
ダビガトランを病的出血のある患者に投与すると大出血のリスクが増大し、時に致死的となる[11]。弁膜症性心房細動患者へ投与すると、血栓症(心臓弁血栓症、脳梗塞、心筋梗塞)のリスクが高くなるので避けるべきである[11][12][13]。
副作用 編集
添付文書に記載されている重大な副作用は、消化管出血や頭蓋内出血等の出血、間質性肺炎、アナフィラキシーである。
そのほか、1%以上に発現する副作用として、消化不良、胃食道炎、悪心、腹部不快感、上腹部痛、心窩部不快感、嘔吐、消化管潰瘍、胸痛、浮腫、鼻出血、皮下出血、血尿が添付文書に記載されている。
出血リスク 編集
米国で実施された後ろ向きコホート研究によると、ワルファリンと比較するとダビガトランの方が頭蓋内出血は少ないものの、他の大出血ならびに“全ての出血”の発現リスクはダビガトランの方が多い[14][15]。製剤中に酒石酸を含んでおり、胃内のpHを下げ、ダビガトランの吸収を良くしている。pHが下がると消化不良となり、それが消化管出血の一因となっている可能性がある[16]。心筋梗塞のリスクが若干ではあるが有意に上昇することがいくつかの臨床試験から判っている[17]。
ブルーレター 編集
2011年8月、日本ベーリンガーインゲルハイムはプラザキサのブルーレターを配布した[18]。発売(2011年3月14日)から同年8月11日までに重篤な出血が81例収集され、内5例が死亡していたためであった。この際に添付文書が改定され、警告欄が設置され、出血の危険性を考慮して投与の適否を慎重に判断することが求められるようになった。また、使用上の注意の欄で中等度腎障害患者、P糖蛋白質阻害剤併用患者のほか、70歳以上の患者および消化管出血の既往のある患者に慎重に投与するよう追記され、ん
薬物動態学 編集
ダビガトランの半減期は12〜14時間であり、服用後2〜3時間で抗凝固能が最大となる[19]。脂肪食はダビガトランの吸収を遅らせてバイオアベイラビリティーを低下させる[1]が、バイオアベイラビリティーに顕著な差はないとする資料もある[8]。
プロトンポンプ阻害薬を併用するとダビガトランの吸収が低下するとの研究がある[20]。キニジン、ベラパミル、アミオダロン等のP糖蛋白質阻害薬を併用していると、薬剤排出が遅延して血中ダビガトラン濃度が上昇する[21]。
歴史 編集
※この節ではダビガトラン(BIBR 953)とダビガトラン エテキシラート(BIBR 1048)を区別して記載する。
ダビガトラン(化合物コード:BIBR 953)は1980年代から強力なセリンプロテアーゼ(トロンビンやトリプシン等)阻害薬として知られていたベンザミジン系トロンビン阻害薬であるα-NAPAP(N-α-(2-ナフチルスルホニルグリシル)-4-アミジノフェニルアラニンピペリジド)に類似した化合物として発見された。エチルエステル化ならびに疎水性側鎖ヘキシルオキシカルボニル基の導入によりバイオアベイラビリティーを向上させたプロドラッグBIBR 1048(ダビガトラン エテキシラート)が得られた[22]。
2008年3月、欧州医薬品庁はダビガトラン エテキシラートを股関節または膝関節置換術後の血栓症予防ならびに非弁膜症性心房細動患者での血栓症予防に用いる旨を承認した[23]。
英国の国民保健サービスは2008年、ダビガトラン エテキシラートの股関節または膝関節手術後の血栓症予防への使用を承認した。
ダビガトラン エテキシラートは2008年6月にカナダ保健省から股関節または膝関節全置換術後の血栓症予防を効能・効果とする製造・販売許可(Notice of Compliance、NOC)を受領した[24]。心房細動患者での塞栓症予防については2010年10月に許可を受領した[25][26]。
米国FDAは、外部専門家の警告があったにもかかわらず[27]、2010年10月、非弁膜症性心房細動患者での脳梗塞予防について使用を承認した[28][29][30][31]。2010年9月の諮問委員会の判断を受けてのものであった[32]。
2011年1月、日本の厚生労働省は、「非弁膜症性心房細動患者における虚血性脳卒中と全身性塞栓症の発症抑制」についてダビガトラン エテキシラートの使用を承認した[33][34]。
2011年2月、米国心臓病学会および米国心臓協会はダビガトラン エテキシラートを非弁膜症性心房細動の管理ガイドラインに書き加え、クラスI[注 2]として推奨した[35]。
2014年5月、FDAはダビガトラン エテキシラートとワルファリンの大規模比較試験(患者数:約134,000名)の結果を報告し、ダビガトラン エテキシラートは全死亡、虚血性脳卒中、脳出血のリスクがワルファリンを下回るとしたが、消化管出血についてはダビガトラン エテキシラートの方が発現率が高かった。心筋梗塞リスクは両薬剤で同程度であった。FDAはダビガトラン エテキシラートの危険・便益比(リスク-ベネフィット比)は良好であると繰り返した[36]。
血中濃度モニタリングの必要性 編集
2014年7月、BMJは一連の調査結果を公表し、患者(特に高齢者)を重篤な出血から護るために血中濃度モニタリングが必要であるという情報をベーリンガーインゲルハイムが知っていたにもかかわらず公にしなかった事を批判した。ベーリンガーの内部資料から、FDAとEMAはプラザキサの血中濃度が患者により大きく異なるという証拠を発見したと明らかにした。BMJの調査に拠ると、ベーリンガーは金融的な動機から、プラザキサは血中濃度測定が必要ない薬剤であると宣伝するためにデータを隠蔽したということが示唆された[37][38]。
注 編集
出典 編集
- ^ a b c d Pradaxa Full Prescribing Information. Boehringer Ingelheim. October 2010.
- ^ Hanley JP, J P (Nov 2004). “Warfarin reversal”. Journal of Clinical Pathology 57 (11): 1132–9. doi:10.1136/jcp.2003.008904. PMC 1770479. PMID 15509671.
- ^ Eerenberg, ES; Kamphuisen, PW; Sijpkens, MK; Meijers, JC; Buller, HR; Levi, M (2011-10-04). “Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects”. Circulation 124 (14): 1573–9. doi:10.1161/CIRCULATIONAHA.111.029017. PMID 21900088 2012年3月15日閲覧。.
- ^ van Ryn J, Stangier J, Haertter S, Liesenfeld KH, Wienen W, Feuring M, Clemens A (Department of Drug Discovery Support, Boehringer Ingelheim Pharma) (Jun 2010). “Dabigatran etexilate--a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity”. Thrombosis and Haemostasis 103 (6): 1116–27. doi:10.1160/TH09-11-0758. PMID 20352166 2012年3月15日閲覧. "Although there is no specific antidote to antagonise the anticoagulant effect of dabigatran, due to its short duration of effect drug discontinuation is usually sufficient to reverse any excessive anticoagulant activity."
- ^ “プラザキサの中和剤idarucizumabに関する新データを公表-独ベーリンガー”. QLife Pro (2014年12月5日). 2015年2月27日閲覧。
- ^ "Boehringer Ingelheim's Investigational Antidote for Pradaxa (dabigatran etexilate mesylate) Receives FDA Breakthrough Therapy Designation" (Press release). Ridgefield, CT: Boehringer Ingelheim’. 26 June 2014. 2014年7月26日閲覧。
- ^ “海外ではNOACに対する中和薬の第III相試験が進行中”. 日経メディカル (2014年9月11日). 2015年2月27日閲覧。
- ^ a b c “プラザキサカプセル75mg/プラザキサカプセル110mg 添付文書” (2014年7月). 2015年2月28日閲覧。
- ^ http://www.drugs.com/pro/pradaxa.html Pradaxa
- ^ Gómez-Outes, A; Terleira-Fernández, AI; Calvo-Rojas, G; Suárez-Gea, ML; Vargas-Castrillón, E (2013). “Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups.”. Thrombosis 2013: 640723. PMID 24455237.
- ^ a b Pradaxa (dabigatran etexilate mesylate) Prescribing Information: http://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=ba74e3cd-b06f-4145-b284-5fd6b84ff3c9#Section_5.4, accessed October 29, 2014.
- ^ “FDA Drug Safety Communication: Pradaxa (dabigatran etexilate mesylate) should not be used in patients with mechanical prosthetic heart valves”. U.S. Food and Drug Administration (FDA). 2014年10月29日閲覧。
- ^ Eikelboom, JW; Connolly, SJ; Brueckmann, M, et al. (September 2013). “Dabigatran versus Warfarin in Patients with Mechanical Heart Valves”. N Engl J Med 369: 1206–1214. doi:10.1056/NEJMoa1300615. PMID 23991661.
- ^ “ダビガトランにワルファリン以上の出血リスク”. 日経メディカル (2014年11月27日). 2015年2月28日閲覧。
- ^ “Risk of Bleeding With Dabigatran in Atrial Fibrillation”. JAMA (2015年1月). 2015年2月28日閲覧。
- ^ ML Blommel; and others (2011). “Dabigatran etexilate: A novel oral direct thrombin inhibitor”. Am J Health Syst Pharm 68 (16): 1506–19. doi:10.2146/ajhp100348. PMID 21817082.
- ^ Uchino K, Hernandez AV; Hernandez (2012). “Dabigatran associated with higher risk of acute coronary events - meta-analysis of noninferiority randomized controlled trials”. Arch. Intern. Med. Online first (5): 397–402. doi:10.1001/archinternmed.2011.1666. PMID 22231617. オリジナルの2012年4月23日時点におけるアーカイブ。.
- ^ “プラザキサカプセル75mg プラザキサカプセル110mg による重篤な出血について” (PDF). 医薬品医療機器総合機構 (2011年8月). 2016年8月4日閲覧。
- ^ Chongnarungsin D; Ratanapo S; Srivali N; Ungprasert P; Suksaranjit P; Ahmed S; Cheungpasitporn W (2012). “In-Depth Review of Stroke Prevention in Patients with Non-Valvular Atrial Fibrillation”. Am. Med. J. 3 (2): 100. doi:10.3844/amjsp.2012.100.103.
- ^ Stangier J, Eriksson BI, Dahl OE; and others (May 2005). “Pharmacokinetic profile of the oral direct thrombin inhibitor dabigatran etexilate in healthy volunteers and patients undergoing total hip replacement”. J Clin Pharmacol 45 (5): 555–63. doi:10.1177/0091270005274550. PMID 15831779.
- ^ "Pradaxa Summary of Product Characteristics" Archived 2011年3月22日, at the Wayback Machine.. European Medicines Agency.
- ^ Hauel NH, Nar H, Priepke H, Ries U, Stassen JM, Wienen W; Nar; Priepke; Ries; Stassen; Wienen (April 2002). “Structure-based design of novel potent nonpeptide thrombin inhibitors”. J Med Chem 45 (9): 1757–66. doi:10.1021/jm0109513. PMID 11960487. 非専門家向けの内容要旨.
- ^ “Pradaxa EPAR”. European Medicines Agency. 2011年1月30日閲覧。[リンク切れ]
- ^ "Summary Basis of Decision (SBD): Pradax" Health Canada. 2008-11-06.
- ^ Kirkey, Sharon (2010年10月29日). “Approval of new drug heralds 'momentous' advance in stroke prevention”. Montreal Gazette 2010年10月29日閲覧。
- ^ "Pradax (Dabigatran Etexilate) Gains Approval In Canada For Stroke Prevention In Atrial Fibrillation" Medical News Today. 28 October 2010.
- ^ Merli G, Spyropoulos AC, Caprini JA; Spyropoulos; Caprini (August 2009). “Use of emerging oral anticoagulants in clinical practice: translating results from clinical trials to orthopedic and general surgical patient populations”. Ann Surg 250 (2): 219–28. doi:10.1097/SLA.0b013e3181ae6dbe. PMID 19638915.
- ^ Connolly, SJ; Ezekowitz, MD; Yusuf, S et al. (September 2009). “Dabigatran versus warfarin in patients with atrial fibrillation” (PDF). N Engl J Med 361 (12): 1139–51. doi:10.1056/NEJMoa0905561. PMID 19717844.
- ^ Turpie AG (January 2008). “New oral anticoagulants in atrial fibrillation”. Eur Heart J 29 (2): 155–65. doi:10.1093/eurheartj/ehm575. PMID 18096568.
- ^ “Boehringer wins first US OK in blood-thinner race”. Thomson Reuters. (2010年10月19日) 2010年10月20日閲覧。
- ^ “FDA approves Pradaxa to prevent stroke in people with atrial fibrillation”. U.S. Food and Drug Administration (FDA). (2010年10月19日)
- ^ Shirley S. Wang (2010年9月20日). “New Blood-Thinner Recommended by FDA Panel”. The Wall Street Journal 2010年10月20日閲覧。
- ^ “経口直接トロンビン阻害薬「プラザキサカプセル」が国内で承認”. THERAPEUTIC RESEARCH (2011年1月21日). 2015年2月28日閲覧。
- ^ “【21日付の承認新薬】抗認知症薬「メマリー」「レミニール」が登場‐数十年ぶりの大型化製品も”. 薬事日報 (2011年1月25日). 2015年2月28日閲覧。
- ^ Wann LS, Curtis AB, Ellenbogen KA, Estes NA, Ezekowitz MD, Jackman WM, January CT, Lowe JE, Page RL, Slotwiner DJ, Stevenson WG, Tracy CM, Jacobs AK; Curtis; Ellenbogen; Estes Na; Ezekowitz; Jackman; January; Lowe et al. (March 2011). “2011 ACCF/AHA/HRS Focused Update on the Management of Patients With Atrial Fibrillation (Update on Dabigatran): A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines”. Circulation 123 (10): 1144–50. doi:10.1161/CIR.0b013e31820f14c0. PMID 21321155.
- ^ “FDA Drug Safety Communication: FDA study of Medicare patients finds risks lower for stroke and death but higher for gastrointestinal bleeding with Pradaxa (dabigatran) compared to warfarin”. 2015年2月28日閲覧。
- ^ Cohen, D (July 2014). “Dabigatran: how the drug company withheld important analyses”. BMJ 349: g4670. doi:10.1136/bmj.g4670. PMID 25055829.
- ^ Moore TJ, Cohen MR, Mattison DR; Cohen; Mattison (July 2014). “Dabigatran, bleeding, and the regulators”. BMJ 349: g4517. doi:10.1136/bmj.g4517. PMID 25056265.
外部リンク 編集
- プラザキサ 製品情報サイト
- Pradaxa.com. Boehringer Ingelheim.
- dabigatran.com. Boehringer Ingelheim.
- Pradaxa For U.S. Health Care Professionals. Boehringer Ingelheim.
- Pradaxa Prescribing Information. Boehringer Ingelheim.
- Pradaxa Medication Guide. Boehringer Ingelheim.
- Dabigatran. MedlinePlus. United States National Library of Medicine (NLM).
- Dabigatran. Drug Information Portal. United States National Library of Medicine (NLM).