ロンギホレン
ロンギホレン (longifolene) は分子式 C15H24 で表されるセスキテルペン炭化水素の一種である。特異な三環性の骨格(ロンギホラン骨格)を持つ。化合物名はヒマラヤマツ(Pinus longifolia、現在は Pinus roxburghii とされる)の精油から得られたことに由来する。
| (+)-ロンギホレン | |
|---|---|
| |
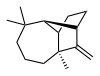
(1R,2S,7S,9S)- 3,3,7-trimethyl- 8-methylenetricyclo- [5.4.0.02,9]undecane | |
| 識別情報 | |
| CAS登録番号 | 475-20-7 |
| ChemSpider | 1406720 |
| 日化辞番号 | J12.093F |
| |
| |
| 特性 | |
| 化学式 | C15H24 |
| モル質量 | 204.36 g/mol |
| 密度 | 0.928 g/cm3 |
| 沸点 |
254 °C (706 mm Hg) |
| 比旋光度 [α]D | +46(neat, 22 °C) |
| 屈折率 (nD) | 1.504 (20 °C、D線) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
存在 編集
化合物名の由来となっている通り、ヒマラヤマツの精油中に5%–10%程度存在する。ロンギホレンは、このテレビン油の分留により供給されている。他にマンダリン、シナモンなどの精油に含有されている。
構造決定 編集
1920年に単離されたが[1]、複雑な構造を持ち転位反応を起こしやすいため、その構造決定は難航した。1953年にロンギホレンの塩化水素付加物の構造がX線結晶構造解析により決定された[2]。塩化水素付加の際にワグナー・メーヤワイン転位が起こるため炭素骨格が変化する。それを考慮に入れて、ロンギホレン自身の化学反応性やラマンスペクトルから構造が推定された[3]。推定構造は最終的にイライアス・コーリーによって1961年になされた全合成[4]により正しいことが確認された。
全合成 編集
コーリーの全合成の一般論文には逆合成解析についての所見が詳しく記載されている[5]。そのため逆合成解析についての解説でしばしば取り上げられる。
コーリーの全合成の概略は以下の通りである。出発原料はウィーラント・ミーシャーケトンであり、これの飽和カルボニル基を選択的にアセタール保護した後、不飽和カルボニル基をウィッティヒ反応でエチリデン化、環外二重結合を四酸化オスミウムでジヒドロキシ化し、二級ヒドロキシ基を選択的にトシル化し、ピナコール転位により7員環への環拡大を行なう。ここでアセタールの脱保護を行なうと、同時に二重結合が共役系に異性化する。この二環性ケトンで分子内マイケル付加を行なうと、ロンギホレンの3つの環ができあがる。7員環上のカルボニル基のα位をメチル化した後、7員環上のカルボニル基を選択的にジチオアセタールとし、もう片方のカルボニル基を一旦アルコールへと還元した後、ナトリウムで脱硫する。還元したアルコールをクロム酸酸化でケトンに戻し、メチルリチウムでメチル化し、脱水するとロンギホレンが得られる。また、ジチオアセタール化をL-(2S,3S)-2,3-ブタンジチオールで行ない、クロマトグラフィーでジアステレオマー分離することで、(+)-ロンギホレンの全合成も行なっている。
反応性 編集
ブレンステッド酸やルイス酸により容易にワグナー・メーヤワイン転位を起こす。ハロゲン化水素との反応では、(IUPAC命名法で)9位がプロトン化されて6位の炭素が7位から8位へと転位し、7位がハロゲン化される。また、非求核性のブレンステッド酸(例えば硫酸)やルイス酸(例えば三フッ化ホウ素-酢酸)ではさらに多段階の転位が進行し、イソロンギホレン(2,2,7,7-テトラメチルトリシクロ[6.2.1.01,6]ウンデカ-5-エン)に変化する。よりシビアな条件ではさらに転位を起こし、1,1-ジメチル-7-イソプロピル-1,2,3,4-テトラヒドロナフタレンなどへと変化する。[6]
生合成 編集
セスキテルペンであるから、ファルネシル二リン酸から生合成される。まず、二リン酸が脱離すると生成するアルケンの末端部分が結合して11員環を形成し、1,3-ヒドリド移動によってアリルカチオンを生じる。さらに架橋閉環が2回起こって三環性中間体となる。これが環上で1,2-アルキル移動を起こすとロンギホレンが生成する。
用途 編集
工業的といえるほどの大きな用途はほとんどないが、イソロンギホレンを酸化したケトンやイソロンギホレンにギ酸を付加させたエステルは木様の香りを持つ香料として使用されるので、その原料として用いられている。また、不斉ヒドロホウ素化用の反応剤としてボランとロンギホレンから得られるジロンギホリルボランが試薬として市販されている。
脚注 編集
- ^ Simonsen J. L. (1920). “LXI.-The constituents of Indian turpentine from Pinus longifolia, Roxb. Part I”. J. Chem. Soc. Trans. 117: 570-578. doi:10.1039/CT9201700570.
- ^ Moffett, R. H.; Rogers, D. (1953). Chem. Ind.: 916.
- ^ a) Naffa, P.; Ourisson, G. (1953). Chem. Ind.: 917.
b) Naffa, P.; Ourisson, G. (1954). Bull. Soc. Chim. Fr. 21: 1115. - ^ Corey, E. J.; Ohno, M.; Vatakencherry, P. A.; Mitra, R. B. (1961). “Total Synthesis of d,l-Longifolene”. J. Am. Chem. Soc. 83: 1251-1253. doi:10.1021/ja01466a056.
- ^ Corey, E. J.; Ohno, M.; Mitra, R. B.; Vatakencherry, P. A. (1964). “Total Synthesis of Longifolene”. J. Am. Chem. Soc. 86: 478–485. doi:10.1021/ja01057a039.
- ^ Dev, S. (1981). “Aspects of Longifolene Chemistry. An Example of Another Facet of Natural Products Chemistry”. Acc. Chem. Res. 14: 82–88. doi:10.1021/ar00063a004.