過酸化亜硝酸塩
過酸化亜硝酸塩(Peroxynitrite)は、ONOO-で表されるイオンを持つ塩である。硝酸塩NO−
3の構造異性体である[1][2]。
| 過酸化亜硝酸塩 | |
|---|---|
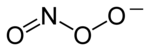
| |
Oxido nitrite | |
| 識別情報 | |
| CAS登録番号 | 19059-14-4 |
| PubChem | 104806 |
| UNII | UR67NH4U77 |
| KEGG | C16845 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | NO3 |
| モル質量 | 62 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

合成
編集過酸化亜硝酸塩は、超酸化物と一酸化窒素の反応で合成される[3][4][5]。
- NO + O−
2 → NO(O
2)−
- H2O2 + NO−
2 → ONOO− + H2O
その存在は、302 nmの吸光度(pH 12, ε302 = 1670 M−1 cm−1)によって示される。
反応
編集ONOO-は、二酸化炭素に求核的に反応する。in vivoでは、二酸化炭素の濃度は約1 mMであり、ONOO-との反応は急速に生じる。そのため、生理的条件下では、ONOO-と二酸化炭素がニトロソペルオキソ一炭酸(ONOOCO2-)を形成する反応は、ONOO-にとって、支配的な経路である。ONOOCO2-は、炭酸ラジカルと二酸化窒素にホモリシス開裂する。このうち約66%では、かご効果によりこれら2つのラジカルが再結合して二酸化炭素と硝酸となり、残りの33%では、ラジカルが溶媒のかごから逃げ出しフリーラジカルとなる。過酸化亜硝酸塩に関連する細胞損傷は、これらのラジカルが原因だと信じられている。
過酸化亜硝酸
編集詳細は「過酸化亜硝酸」を参照
過酸化亜硝酸塩は塩基性溶媒中で安定であるが、共役酸の過酸化亜硝酸は非常に反応性が高い。
関連項目
編集出典
編集- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Koppenol, W. H (1998). “The chemistry of peroxynitrite, a biological toxin”. Química Nova 21 (3): 326–331. doi:10.1590/S0100-40421998000300014.
- ^ Bohle, D. Scott; Sagan, Elisabeth S. (2004). “Tetramethylammonium Salts of Superoxide and Peroxynitrite”. Inorganic Syntheses: 36. doi:10.1002/0471653683.ch1.
- ^ Pacher, P; Beckman, J. S; Liaudet, L (2007). “Nitric oxide and peroxynitrite in health and disease”. Physiological Reviews 87 (1): 315–424. doi:10.1152/physrev.00029.2006. PMC 2248324. PMID 17237348.
- ^ Szabó, C; Ischiropoulos, H; Radi, R (2007). “Peroxynitrite: Biochemistry, pathophysiology and development of therapeutics”. Nature Reviews Drug Discovery 6 (8): 662–80. doi:10.1038/nrd2222. PMID 17667957.
- ^ Beckman, J. S; Koppenol, W. H (1996). “Nitric oxide, superoxide, and peroxynitrite: The good, the bad, and ugly”. American Journal of Physiology. Cell Physiology 271 (5 Pt 1): C1424–37. doi:10.1152/ajpcell.1996.271.5.C1424. PMID 8944624.