シスチンノット
シスチンノット(英: cystine knot)は、3つのジスルフィド結合(システイン残基対の間で形成される結合)が含まれるタンパク質構造モチーフである。2つのジスルフィド結合の間のポリペプチド領域がループを形成し、そこを3つ目のジスルフィド結合が通過することで、ロタキサン構造が形成される。シスチンノットモチーフはタンパク質の構造を安定化し、その構造はさまざまな生物種のタンパク質で保存されている[2][3][4]。シスチンノットには次の3つの種類が存在し、それぞれジスルフィド結合のトポロジーが異なる。
- growth factor cystine knot(GFCK)
- インヒビターシスチンノット(ICK) - クモやヘビの毒に一般的
- 環状シスチンノット(cyclic cystine knot、CCK)またはシクロチド
| Cystine-knot domain | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
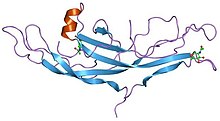 ヒト絨毛性ゴナドトロピンの構造[1] | |||||||||||
| 識別子 | |||||||||||
| 略号 | Cys_knot | ||||||||||
| Pfam | PF00007 | ||||||||||
| Pfam clan | CL0079 | ||||||||||
| InterPro | IPR006208 | ||||||||||
| SCOP | 1hcn | ||||||||||
| SUPERFAMILY | 1hcn | ||||||||||
| |||||||||||
GFCKモチーフは、神経成長因子(NGF)の構造で初めて観察された。この構造はTom BlundellらによってX線結晶構造解析によって解かれ、1991年にNature誌で発表された[5]。GFCK構造は4つのスーパーファミリーにみられ、NGF、TGF-β、血小板由来成長因子(PDGF)、そしてヒト絨毛性ゴナドトロピンといった糖タンパク質ホルモンなどが含まれている。これらはシスチンノットモチーフの存在によって構造的に関連しているが、その配列は大きく異なる[6]。これまで決定されたGFCKの構造は全て二量体であるが、二量体化の様式はクラスによって異なっている[7]。
ICKモチーフは、3本の逆平行βシートが3つのジスルフィド結合で連結されることでノットのコア部分を形成している構造モチーフである。ICKモチーフは動物や植物など複数の門でみられるが、ヘビ、クモ、サソリなどの毒ペプチドに多くみられる。ICKモチーフを含有するκ-PVIIAペプチドは酵素的に主鎖の環状化を行うことができる。ジスルフィド結合の連結とICKモチーフの一般的配列パターンが環状化を補助する安定性をもたらしており、将来的な新規治療分子開発の際のタンパク質改変技術としての応用の可能性がある[8]。
CCKモチーフは、さまざまな植物からシクロチドが単離された際に発見された。CCKモチーフは、環状の骨格、3本のストランドからなるβシート、そしてシスチンノットという構造的特徴を有する[9]。
シスチンノットモチーフファミリーには、C-terminal cystine knot(CTCK)と呼ばれる新たなグループも発見されている。これらのタンパク質は、システインに富むC末端領域の約90アミノ酸に共通性がみられる[10]。
薬剤への応用
編集シスチンノットモチーフはその安定性と構造により、薬剤設計への応用の可能性が示唆されている。モチーフのジスルフィド結合とβシート構造との間の水素結合によって、構造はきわめて効率的に安定化されている。さらに、モチーフのサイズは約30アミノ酸と小さい。これら2つの特徴によって熱安定性、化学的安定性、タンパク質分解耐性を示し、薬剤送達用途に魅力的な生体分子となっている[11]。シスチンノットタンパク質は65 °Cの温度下や1M HCl、1M NaOH中でも構造的・機能的完全性を喪失しないことが示されている[12]。また、口腔内や一部の腸内プロテアーゼに対する耐性を有し、経口投与が可能であることが示唆される。将来的な応用としては、疼痛管理や抗ウイルス・抗細菌機能が考えられている[12]。
出典
編集- ^ “Structure of human chorionic gonadotropin at 2.6 A resolution from MAD analysis of the selenomethionyl protein”. Structure 2 (6): 545–58. (June 1994). doi:10.1016/s0969-2126(00)00054-x. PMID 7922031.
- ^ “Cystine Knots”. The Cyclotide Webpage. 2015年2月5日時点のオリジナルよりアーカイブ。2019年4月24日閲覧。
- ^ Sherbet, G.V. (2011), “Growth Factor Families” (英語), Growth Factors and Their Receptors in Cell Differentiation, Cancer and Cancer Therapy, Elsevier, pp. 3–5, doi:10.1016/b978-0-12-387819-9.00002-5, ISBN 9780123878199 2019年5月1日閲覧。
- ^ Vitt, Ursula A.; Hsu, Sheau Y.; Hsueh, Aaron J. W. (2001-05-01). “Evolution and Classification of Cystine Knot-Containing Hormones and Related Extracellular Signaling Molecules” (英語). Molecular Endocrinology 15 (5): 681–694. doi:10.1210/mend.15.5.0639. ISSN 0888-8809. PMID 11328851.
- ^ PDB: 1bet; “New protein fold revealed by a 2.3-A resolution crystal structure of nerve growth factor”. Nature 354 (6352): 411–4. (December 1991). Bibcode: 1991Natur.354..411M. doi:10.1038/354411a0. PMID 1956407.
- ^ “The cystine-knot growth-factor superfamily”. Annual Review of Biophysics and Biomolecular Structure 24 (1): 269–91. (1995). doi:10.1146/annurev.bb.24.060195.001413. PMID 7663117.
- ^ “Structural biology of glycoprotein hormones and their receptors: insights to signaling”. Molecular and Cellular Endocrinology 382 (1): 424–451. (January 2014). doi:10.1016/j.mce.2013.08.021. PMID 24001578.
- ^ Kwon, Soohyun; Bosmans, Frank; Kaas, Quentin; Cheneval, Oliver; Cinibear, Anne C; Rosengren, K Johan; Wang, Conan K; Schroeder, Christina I et al. (19 April 2016). “Efficient enzymatic cyclization of an inhibitory cystine knot‐containing peptide”. Biotechnology and Bioengineering 113 (10): 2202–2212. doi:10.1002/bit.25993. PMC 5526200. PMID 27093300.
- ^ “Plant cyclotides: A unique family of cyclic and knotted proteins that defines the cyclic cystine knot structural motif”. Journal of Molecular Biology 294 (5): 1327–36. (December 1999). doi:10.1006/jmbi.1999.3383. PMID 10600388.
- ^ “Tying the knot: the cystine signature and molecular-recognition processes of the vascular endothelial growth factor family of angiogenic cytokines”. The FEBS Journal 278 (22): 4304–22. (November 2011). doi:10.1111/j.1742-4658.2011.08350.x. PMC 3328748. PMID 21917115.
- ^ Kolmar, Harald (2009-10). “Biological diversity and therapeutic potential of natural and engineered cystine knot miniproteins”. Current Opinion in Pharmacology 9 (5): 608–614. doi:10.1016/j.coph.2009.05.004. ISSN 1471-4973. PMID 19523876.
- ^ a b Craik, D. J.; Daly, N. L.; Waine, C. (2001-01). “The cystine knot motif in toxins and implications for drug design”. Toxicon: Official Journal of the International Society on Toxinology 39 (1): 43–60. doi:10.1016/s0041-0101(00)00160-4. ISSN 0041-0101. PMID 10936622.