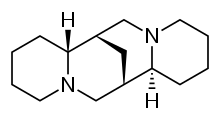
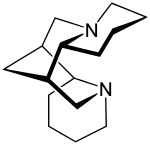
スパルテイン
スパルテイン(sparteine)は、クラスIa抗不整脈薬の一種。ナトリウムチャネル阻害剤である。スパルテインはエニシダ(Cytisus scoparius) から抽出できるアルカロイドである。ザッショクノボリフジ (Lupinus mutabilis) 中の主要なアルカロイドであり、二価のカルシウムおよびマグネシウムをキレートすると考えられている。アメリカ食品医薬品局 (FDA) ではヒトに対する抗不整脈薬としては承認されておらず、ヴォーン・ウィリアムズ分類には含まれていない。
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com |
国別販売名(英語) International Drug Names |
| 識別 | |
| CAS番号 | 90-39-1 |
| ATCコード | C01BA04 (WHO) |
| PubChem | CID: 644020 |
| DrugBank | DB06727 |
| ChemSpider | 559096 |
| UNII | 298897D62S |
| KEGG | D01041 |
| ChEBI | CHEBI:28827 |
| ChEMBL | CHEMBL44625 |
| 化学的データ | |
| 化学式 | C15H26N2 |
| 分子量 | 234.380 g/mol |
| |
| |
生合成
編集スパルテインは、L-リジンの3本のC5鎖に由来する四環性ビスキノリジジン環系を含むルピンアルカロイドである[1]。生合成における最初の中間体は、リジンデカルボキシラーゼ (LDC) によって触媒されるリジンの脱炭酸生成物であるカダベリンである[2]。3ユニットのカダベリンがキノリジジン骨格を形成するために使われる。生成機構は酵素レベルやトレーサー実験によって研究されているが正確な合成ルートは未だ不明である。
13C-15N-二重ラベルカダベリンを用いたトレーサー研究によって、3ユニットのカダベリンがスパルテインに取り込まれ、2ユニットのカダベリンからの2つのC-N結合がそのまま残っていることが示された[3]。これは、2H NMRラベル実験によっても確認された[4]。
酵素的証拠は、遊離中間体の生成無しに酵素に結合した中間体を経て3分子のカダベリンがキノリジジン環に変換されることを示している。当初は、カダベリンの対応するアルデヒドである5-アミノペンタナールへの変換はジアミンオキシダーゼによって触媒されると考えられていた[5]。アルデヒドは次に自発的に対応するシッフ塩基であるΔ1-ピペリデインへと変換される。アルドール型反応による2分子のカップリングが、Δ1-ピペリデインの互変異性体間で起こる。イミンは次に対応するアルデヒド/アミンへと加水分解される。一級アミンは次にアルデヒドへと酸化され、続くイミンの形成によってキノリジジン環が得られる[5]。この機構の概要は下図を参照のこと。しかし、前述したとおり、中間体は単離されていない。
細菌の酵素的証拠は、トランスアミナーゼである17-オキソスパルテインシンターゼ (OS) の存在を示している[6][7][8][9][10][11]。脱アミノ化カダベリンは酵素から放出されず、ゆえに酵素は連続してキノリジジン骨格の生成を触媒すると推量できる(図2)[9][10][11]。7-オキソスパルテインは4ユニットのピルビン酸をNH2受容体として必要とし、4分子のアラニンが生成される(図3)。リジンデカルボキシラーゼおよびキノリジジン骨格生成酵素は共に葉緑体に局在している[12]。
脚注
編集- ^ Dewick, P.M. (2009). Medicinal Natural Products, 3rd. Ed.. Wiley. pp. 311
- ^ Golebiewski, W.M., Spenser (1988). “Biosynthesis of the lupine alkaloids. II. Sparteine and lupanine”. Can. J. Chem. 66 (7): 1734. doi:10.1139/v88-280.
- ^ Rana, J., Robins, D.J. (1983). “Quinolizidine alkaloid biosynthesis: incorporation of [1-amino-15N,1-13C]cadaverine into sparteine”. J. Chem. Soc., Chem. Commun. 22: 1335–1336. doi:10.1039/C39830001335.
- ^ Fraser, A. M.; Robins, D. J. (1987). “Application of 2H n.m.r. spectroscopy to study the incorporation of enantiomeric 2H-labelled cadaverines into quinolizidine alkaloids”. J. Chem. Soc., Perkin Trans. 1: 105-109. doi:10.1039/P19870000105.
- ^ a b Aniszewski, T. (2007). Alkaloids - Secrets of Life, 1st Ed.. Elseview. pp. 98–101
- ^ Wink, M., Hartmann, T. (1984). Enzymology of Quinolizidine Alkaloid Biosynthesis; Natural Products Chemistry: Zalewski and Skolik (Eds.). pp. 511–520
- ^ Wink, M. (1987). “Quinolizidine Alkaloids: Biochemistry, Metabolism, and Function in Plants and Cell Suspension Cultures”. Plant Medica: 509–514.
- ^ Wink, M., Hartmann, T. (1979). “Cadaverine--pyruvate transamination: the principal step of enzymatic quinolizidine alkaloid biosynthesis in Lupinus polyphyllus cell suspension cultures”. FEBS Lett. 101 (2): 343–346. doi:10.1016/0014-5793(79)81040-6. PMID 446758.
- ^ a b Perrey, R., Wink, M. (1988). “On the role of Δ1-piperideine and tripiperideine in the biosynthesis of quinolizidine alkaloids”. Z. Naturforsch C 43: 363–369.
- ^ a b Atta-ur-Rahman (Ed.) (1995). Natural Products Chemistry. 15. Elsevier. pp. 537. ISBN 0-444-42691-4
- ^ a b Roberts, M., Wink, M. (Eds.) (1998). Alkaloids: Biochemistry, Ecology, and Medicinal Applications.. Plenum Press. pp. 112–114
- ^ Wink, M., Hartmann, T. (1980). “Enzymatic synthesis of quinolizidine alkaloids in lupin chloroplasts”. Z. Naturforsh 35: 93–97.