タゼメトスタット
タゼメトスタット[1](Tazemetostat)は、完全切除[注 1]の対象とならない、転移性[注 2]または局所進行性[注 3]の上皮性肉腫を持つ16歳以上の成人および青年の治療に使用される抗がん剤である[2]。
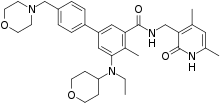 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Tazverik |
| Drugs.com | monograph |
| MedlinePlus | a620018 |
| ライセンス | US Daily Med:リンク |
| 法的規制 |
|
| 識別 | |
| CAS番号 | 1403254-99-8 |
| ATCコード | None |
| PubChem | CID: 66558664 |
| DrugBank | DB12887 |
| ChemSpider | 30208713 |
| UNII | Q40W93WPE1 |
| KEGG | D11485 |
| ChEMBL | CHEMBL3414621 |
| 別名 | EPZ-6438 |
| 化学的データ | |
| 化学式 | C34H44N4O4 |
| 分子量 | 572.75 g·mol−1 |
| |
| |
最も一般的な副作用は、痛み、疲労、吐き気、食欲不振、嘔吐、便秘である[2]。
効能・効果 編集
副作用 編集
添付文書に記載されている重大な副作用は[3]、
- 骨髄抑制 - 血小板減少(11.3%)、好中球減少(9.7%)、リンパ球減少(8.1%)、貧血(6.5%)など
- 感染症(30.6%) - 肺炎、ニューモシスチス肺炎、異型肺炎、肺感染(各1.6%)など
である。
相互作用 編集
作用機序 編集
タゼメトスタットは、強力な選択的EZH2阻害剤として作用する抗がん剤である[4]。タゼメトスタットは、EZH2(メチル基転移酵素の一種)の活性を阻害することで、がん細胞の増殖を抑えることができる[2]。上皮性肉腫のほとんどの症例は、四肢の皮下の軟部組織から始まるが、身体の他の部位で始まることもありうる[2]。がんが身体の一部分に限局している場合は、外科的な除去が主な治療法と考えられる[2]。また、化学療法や放射線療法が行われることもある[2]。しかし、治療を行っても局所進行または転移する可能性が高く、診断時には約50%の患者が転移性疾患を有している[2]。転移性疾患は、患者の生命を脅かすものと考えられる[2]。
NCI Drug Dictionaryによると、タゼメトスタットは、経口投与可能な低分子の選択的S-アデノシルメチオニン(SAM)競合的EZH2阻害剤であり、抗腫瘍活性が期待される。EZH2は、ヒストンメチル基転移酵素(HMT)の一種であり、さまざまながん細胞で過剰発現または変異しており、腫瘍細胞の増殖に重要な役割を果たしている。タゼメトスタットは、経口投与で、野生型および変異型のEZH2の活性を選択的に阻害する。EZH2を阻害すると、ヒストンH3のリジン27(H3K27)のメチル化が特異的に阻害され、EZH2変異型のがん細胞では、がん経路に関連する遺伝子の発現パターンが変化し、腫瘍細胞の増殖が抑制される[5]。
臨床試験 編集
FDAは、転移性または局所進行性の上皮性肉腫の被験者62名を対象とした臨床試験(NCT02601950)の結果に基づき、2020年1月にタゼメトスタットを承認した[2][7]。本臨床試験では、被験者は、病状が進行するか、許容できないレベルの毒性を示すまで、タゼメトスタット800mgを1日2回投与された[2][7]。本試験では、8週間ごとに腫瘍の反応が評価され、治療中に腫瘍が完全または部分的に縮小した被験者の数(全奏効率)が計算された[2]。全奏効率は15%で、完全奏功は1.6%、部分奏功は13%であった[2]。奏効した9名のうち、6名(67%)の被験者が6ヵ月以上の奏効を示した[2]。
本試験は、フランス、英国、台湾、イタリア、カナダ、ベルギー、米国の22施設で実施された[7]。
FDAは、タゼメトスタットの迅速承認および希少疾病用医薬品指定の申請を認可し、2020年1月に販売承認した[2]。
日本では第I相臨床試験が2017年1月に開始され[8]、国内第II相臨床試験でEZH2 遺伝子変異陽性濾胞性リンパ腫での有効性と安全性が確認され[8]、2020年7月に承認申請され[9]、2021年6月に承認された。
注釈 編集
参考資料 編集
- ^ “KEGG DRUG: タゼメトスタット臭化水素酸塩”. www.genome.jp. 2021年10月8日閲覧。
- ^ a b c d e f g h i j k l m n o "FDA approves first treatment option specifically for patients with epithelioid sarcoma, a rare soft tissue cancer". U.S. Food and Drug Administration (FDA) (Press release). 23 January 2020. 2020年1月23日閲覧。 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ a b c d “タズベリク錠200mg 添付文書”. www.info.pmda.go.jp. 2021年10月8日閲覧。
- ^ “Emerging EZH2 Inhibitors and Their Application in Lymphoma”. Curr Hematol Malig Rep 13 (5): 369–382. (October 2018). doi:10.1007/s11899-018-0466-6. PMID 30112706.
- ^ “Tazemetostat”. NCI Drug Dictionary. National Cancer Institute. 2021年10月8日閲覧。
- ^ “New Drug Therapy Approvals 2020”. U.S. Food and Drug Administration (FDA) (2020年12月31日). 2021年1月17日閲覧。 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ a b c “Drug Trials Snapshots: Tazverik”. U.S. Food and Drug Administration (FDA) (2020年1月23日). 2020年2月22日閲覧。 この記述には、アメリカ合衆国内でパブリックドメインとなっている記述を含む。
- ^ a b “タズベリク錠200mg インタビューフォーム”. www.info.pmda.go.jp. 2021年10月8日閲覧。
- ^ “抗がん剤タゼメトスタット、日本においてEZH2遺伝子変異陽性の濾胞性リンパ腫に係る適応で新薬承認申請書を提出 | ニュースリリース:2020年 | エーザイ株式会社”. www.eisai.co.jp. 2021年10月8日閲覧。
外部リンク 編集
- “Tazemetostat”. Drug Information Portal. U.S. National Library of Medicine. 2021年10月8日閲覧。