八面体形分子構造
化学において八面体形分子構造(はちめんたいがたぶんしこうぞう、英: Octahedral molecular geometry)とは、6個の配位子が中心原子の周りに対称的に配置し、それが正八面体の角頂点を形成する分子構造のことである。八面体形分子は通常その配位子間の結合はない。完全な正八面体は点群 Oh に属し、八面体形分子には六フッ化硫黄やモリブデンヘキサカルボニルなどがある。
| 八面体形分子構造 | |
|---|---|
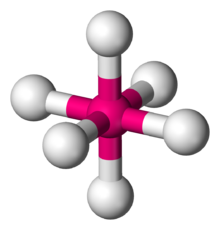 | |
| 例 | SF6, Mo(CO)6 |
| 点群 | Oh |
| 立体数 | 6 |
| 配位数 | 6 |
| 結合角 | 90° |
| μ(極性) | 0 |

八面体配位構造の概念は、配位化合物の化学量論と化学異性を説明するためにアルフレート・ヴェルナーによって開拓された。彼の考察によって配位化合物の異性体数が合理的に許容されることとなった。アミンや簡単なアニオンを含む八面体遷移金属錯体はしばしばヴェルナー錯体と関連づけられる。
八面体形錯体の異性体
編集2種またはそれ以上の配位子の種類が八面体の中心金属に配位することによって異性体が発生する。それら異性体の命名は、異なる配位子同士の配置と数に依存する。
cisとtrans
編集MLa4Lb2では、2種の異性体が存在する。Lbが互いに隣接しているとき cis 型で、Lbが互いに180°の位置関係にあると trans 型である。
MLa2Lb2Lc2でも、cis型 と trans型 が可能である。La、Lb、Lcのすべての配位子が trans型 という場合と、1配位子だけが trans型 で他の2配位子が cis 型という場合がある。
Facialとmeridional
編集MLa3Lb3では、 同じ3配位子が相互に cis 型である facial型 ( fac )と、同じ3配位子が同一平面上にある meridional 型( mer )の2種の異性体が可能である。
-
cis -[CoCl2(NH3)4]+ -
trans -[CoCl2(NH3)4]+ -
fac -[CoCl3(NH3)3] -
mer -[CoCl3(NH3)3]
キラリティー
編集二座配位子を2個以上持つ錯体にはキラリティーが発生する。3回回転軸から見て、二座配位子が形成する螺旋構造が左回りのものはΛ(ラムダ)、右回りのものはΔ(デルタ)体と呼ぶ。
-
Λ-[Fe(ox)3]3− -
Δ-[Fe(ox)3]3− -
Λ- cis -[CoCl2(en)2]+ -
Δ- cis -[CoCl2(en)2]+
その他
編集可能な異性体の数は、八面体錯体の配位子の種類がすべて異なるとき最大の30個となる。以下の表は単座配位子の組み合わせによって可能なすべての異性体数を表す。
| 化学式 | 異性体数 | 鏡像異性体の数 |
|---|---|---|
| ML6 | 1 | 0 |
| MLa5Lb | 1 | 0 |
| MLa4Lb2 | 2 | 0 |
| MLa3Lb3 | 2 | 0 |
| MLa4LbLc | 2 | 0 |
| MLa3Lb2Lc | 3 | 0 |
| MLa2Lb2Lc2 | 6 | 1 |
| MLa3LbLcLd | 5 | 1 |
| MLa2Lb2LcLd | 8 | 2 |
| MLa2LbLcLdLe | 15 | 6 |
| MLaLbLcLdLeLf | 30 | 15 |
このとき、MLaLbLcLdLeLfの15個のジアステレオマーはすべてキラルであるのに対し、MLa2LbLcLdLeのジアステレオマーの6つはキラルであるが、Laが trans 型のときの3種はそうではない。これらのことから、八面体型分子構造は有機化学を支配する四面体形分子構造よりもずっと複雑であることが分かる。四面体型分子 MLaLbLcLd では鏡像異性体は一対しかなく、有機化学において2つのジアステレオマーを作り出すには最低2つの不斉炭素が必要となる。