ガバペンチン
ガバペンチン(英: Gabapentin)は、GABA誘導体の抗てんかん薬である[1]。日本では商品名ガバペンで抗てんかん薬として流通している[2]。プロドラッグであるガバペンチン エナカルビル(商品名:レグナイト)はむずむず脚症候群の治療薬として販売される[3]。
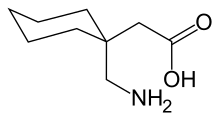 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | 経口 |
| 薬物動態データ | |
| 血漿タンパク結合 | 3%未満 |
| 代謝 | ほぼ代謝されない |
| 半減期 | 5-7時間 |
| 排泄 | 腎臓 |
| 識別 | |
| CAS番号 | 60142-96-3 |
| ATCコード | N03AX12 (WHO) |
| PubChem | CID: 3446 |
| DrugBank | APRD00015 |
| KEGG | D00332 |
| 化学的データ | |
| 化学式 | C9H17NO2 |
| 分子量 | 171.237 g/mol |
| |
ガバペンの適応は、他の抗てんかん薬の効果が認められない際の補助薬である。レグナイトの適応は、慎重に国際的な診断基準に従い、中等度から高度の他が原因でないむずむず脚症候群である。
歴史
編集ガバペンチンは1973年、ワーナー・ランバート(Warner Lambert、現:ファイザー)の西ドイツ研究所で、抗てんかん薬として合成された。イギリスおよびアメリカ合衆国で、成人におけるてんかんの部分発作に対する併用療法として承認され、1999年以降、欧州連合・アメリカで小児の適応を取得後は、アジアを含め世界中で抗てんかん薬として広く使用されている。[要出典]
日本では1993年に臨床試験が開始され、国内外の臨床試験の結果、既存の抗てんかん薬では発作の抑制が不十分な部分発作に、併用での有用性が認められた。2006年に製造販売承認を取得し、同年9月25日に発売を開始した。
ワーナー・ランバートの医療情報担当者が、承認外の11の適応に効くと医師に病気喧伝し、適応外使用を勧めていたことが、1996年の内部告発と提訴をきっかけに判明。全米各地で団体訴訟が発生した[要出典]。これにはFDAの承認を取得した帯状疱疹後神経痛も含む。
2003年に誇大宣伝などの独占禁止法違反で、アメリカ合衆国連邦政府による調査が実施され、この結果ファイザーは、2003年末に4億2700万米ドル以上の巨額の引当金を計上した。[要出典]
適応
編集ガバペンの日本での適応
編集- 他の抗てんかん薬で十分な効果が認められないてんかん患者の部分発作(二次性全般化発作を含む)に対する抗てんかん薬との併用療法
国内臨床試験において、単独投与での使用経験はない[4]。
レグナイトの適応
編集- 中等度から高度の特発性レストレスレッグス症候群(下肢静止不能症候群)
使用上の注意として、国際レストレスレッグス症候群研究グループの診断基準および重症度スケールに基づき慎重に実施し、基準を満たす場合にのみとされる。特発性とは他が原因でないということである。たとえば、薬物または物質による睡眠関連運動障害のひとつとして、ドーパミン受容体を遮断する抗精神病薬による錐体外路症状がある[5]。
有効性
編集代謝
編集ガバペンチンはほとんど代謝の影響を受けず、あるいは他の代謝を誘導しない。
副作用
編集ガバペンチンの副作用は以下のようなものがある。
- 傾眠傾向
- 浮動性めまい
- 頭痛
- 複視
- 倦怠感
アメリカでは、抗痙攣薬すべてに自殺企図や自殺念慮を高める旨の警告表示がなされている[7]。日本でも、精神疾患に適応のあるほかの抗痙攣薬において、自殺念慮の症状が悪化する可能性についての警告表示がある[8]。
抗てんかん薬全般に言えることであるが、連用中における急激な減量あるいは中止時に、てんかん発作の増悪またはてんかん重積状態のおそれがあるため、徐々に減量する。
離脱症状と依存
編集離脱症状は、ガバペンチンの使用を中断してから典型的には1-2日後に発生する[9]。興奮、混乱、失見当識が最も頻繁に報告されており、続いて胃腸症状の訴えと発汗、さらにまれに振戦、頻脈、高血圧、不眠症を起こす[9]。時に、離脱けいれん(発作)を起こす[10]。これらすべての症状は、ガバペンチンを元のように服用するとおさまる[9]
ガバペンチン自体には、嗜癖性がないようで、ヒトと動物実験では報酬効果がなく、ガバペンチン乱用者の多数はオピオイドや鎮静薬の乱用経験がある [10]。 これらの人では、ガバペンチンが不安のようなオピオイド度離脱症状を軽減している[11]。
禁忌
編集ガバペンチンの禁忌には以下のようなものがある。
絶対禁忌
編集- 本剤の成分に対し過敏症の既往歴のある患者
ガバペンチンの投与中に薬剤性過敏症症候群が起きた場合、初期症状として発疹、発熱がみられ、さらに肝機能障害などの臓器障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現などを伴う遅発性の重篤な過敏症状が現れることがあるため、十分な観察をする必要がある。このような症状が現れた場合には投与を中止し適切な処置を行うこと。なお、発疹、発熱、肝機能障害などの症状が再燃あるいは遷延化することがあるので注意すること、となっている[12][13]。
慎重投与
編集- 腎機能障害のある患者
- 高齢者(腎機能が低下している場合)
- 低出生体重児、新生児、乳児または3歳未満の幼児 - 外国で実施された3〜12歳の幼児および小児患者を対象とした臨床試験では、投与時の感情不安定、敵意、運動過多および思考障害の発現率がプラセボ群と比較して、有意に高かったと報告されている。なお、日本では臨床試験は行われていない。
アメリカ食品医薬品局 (FDA) によるガバペンチンの胎児危険度分類はカテゴリー「C」である。これは、動物実験では胎児への有害作用が証明されているが、その薬物の潜在的な利益によって、潜在的なリスクがあるにもかかわらず妊婦への使用が正当化されることがありうることを意味する。しかし、動物実験において動物実験で、胎児・出生児に骨化遅延、尿管拡張・腎盂拡張、着床後胚死亡率の増加が報告されている[要出典]。
なお、乳汁中へ移行することが認められているため、授乳中の婦人には投与中は授乳を避けた方がよい、とされる。
関連項目
編集出典
編集- ^ Baillie, J Kenneth; Ian Power (2006-01). “The mechanism of action of gabapentin in neuropathic pain”. Current Opinion in Investigational Drugs (London, England: 2000) 7 (1): 33–9 2009年4月19日閲覧。.
- ^ https://www.kegg.jp/medicus-bin/japic_med?japic_code=00052158
- ^ https://www.kegg.jp/medicus-bin/japic_med?japic_code=00060660
- ^ “ガバペン錠”. 2015年8月31日閲覧。
- ^ アメリカ睡眠医学会『睡眠障害国際分類第2版診断とコードの手引』医学書院、2010年7月、189-190、195 -196頁。ISBN 978-4-260-00917-1。、ICSD-2, American Academy of Sleep Medicine, 2005.
- ^ The Lancet, Early Online Publication, 28 August 2012.
- ^ “Postmarket Drug Safety Information for Patients and Providers > Information for Healthcare Professionals: Suicidal Behavior and Ideation and Antiepileptic Drugs”. U.S. Food and Drug Administration (FDA) (2008年1月31日). 2013年1月15日閲覧。
- ^ テグレトール錠100mg/テグレトール錠200mg/テグレトール細粒50% デパケン錠100mg/デパケン錠200mg ラミクタール錠小児用2mg/ ラミクタール錠小児用5mg/ ラミクタール錠25mg/ ラミクタール錠100mg トピナ錠25mg/トピナ錠50mg/トピナ錠100mg添付文書情報(独立行政法人医薬品医療機器総合機構)
- ^ a b c Mersfelder TL, Nichols WH (March 2016). “Gabapentin: Abuse, Dependence, and Withdrawal”. The Annals of Pharmacotherapy 50 (3): 229–33. doi:10.1177/1060028015620800. PMID 26721643.
- ^ a b “How addictive are gabapentin and pregabalin? A systematic review”. European Neuropsychopharmacology 27 (12): 1185–1215. (December 2017). doi:10.1016/j.euroneuro.2017.08.430. PMID 28988943.
- ^ “On the addictive power of gabapentinoids: a mini-review”. Psychiatria Danubina 30 (2): 142–149. (June 2018). doi:10.24869/psyd.2018.142. PMID 29930223.
- ^ “ガバペン錠200mg/ガバペン錠300mg/ガバペン錠400mg 添付文書” (2016年4月). 2016年11月4日閲覧。
- ^ “レグナイト錠300mg 添付文書” (2016年4月). 2016年11月4日閲覧。
外部リンク
編集- 痛みと鎮痛の基礎知識 - Pain Relief
- 医薬品医療機器情報提供ページ - 独立行政法人 医薬品医療機器総合機構