ヘキサアンミンコバルト(III)塩化物
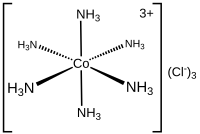
ヘキサアンミンコバルト(III)塩化物(英語:Hexaamminecobalt(III) chloride)は化学式が[Co(NH3)6]Cl3で表される化合物である。この錯体 は、典型的なヴェルナー錯体である。この錯体の陽イオンは[Co(NH3)6]3+であり、それにCl−イオンが3つ結合している。この陽イオンはコバルト原子に6個のアンモニア分子が配位子として結合した金属アンミン錯体である。
| ヘキサアンミンコバルト(III)塩化物 | |
|---|---|
| |

| |
Hexaamminecobalt(III) chloride | |
別称 塩化コバルトヘキサミン | |
| 識別情報 | |
| CAS登録番号 | 10534-89-1 |
| UNII | 240056WZHT |
| 特性 | |
| 化学式 | H18N6Cl3Co |
| モル質量 | 267.48 g/mol |
| 外観 | 黄色またはオレンジ色の結晶 |
| 密度 | 1.71 g/cm3, |
| 融点 |
分解 |
| 水への溶解度 | 0.26 mol/L (20 °C) 三臭化物: 0.04mol/L (18 °C) |
| 溶解度 | アンモニアに可溶 |
| 構造 | |
| 配位構造 | 八面体形分子構造 |
| 双極子モーメント | 0 D |
| 危険性 | |
| 主な危険性 | 毒性 |
| Rフレーズ | 36/37/38 |
| Sフレーズ | なし |
| 関連する物質 | |
| その他の陰イオン | [Co(NH3)6]Br3 [Co(NH3)6](OAc)3 |
| その他の陽イオン | [Cr(NH3)6]Cl3 [Ni(NH3)6]Cl2 |
| 関連する化合物 | [Co(en)3]Cl3 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
もともとこの化合物はルテオ(luteo、ラテン語で黄色という意味) コバルト錯体と呼ばれていたが、近代になって化学が発展し、色が構造に比べあまり重要ではないことがわかってきてからこの名前は使われなくなった。同様に色で呼ばれていた錯体としてペンタアンミン錯体はパープレオ(purpureo、ラテン語で紫)、テトラアンミン錯体の2つの異性体はそれぞれプラセオ(praseo、ギリシャ語で緑)とバイオレオ(violeo、ラテン語で菫色)と呼ばれていた[1]。
性質と構造
編集[Co(NH3)6]3+は八面体形分子構造をとり、低スピン配置の3d6電子を持つ反磁性の物質である。このカチオンは18電子則(英語版)に従っており、置換不活性金属錯体(exchange inert metal complex)の一つであると考えられている。不活性であることがはっきりわかるため、[Co(NH3)6]Cl3は濃縮された塩酸で再結晶させても不変である。アンモニア部分は中心のコバルトイオンに非常に強く結合しているため、分解されてプロトン化されることはない。一方、[Ni(NH3)6]Cl2のような不安定なアンミン錯体は速やかに酸と反応してしまう。加熱されると、ヘキサアンミンコバルト(III)イオンはアンモニアの配位子を失い、最終的により強い酸化剤になる。
[Co(NH3)6]Cl3の塩化物イオンは硝酸イオン、臭化物イオン、ヨウ化物イオンなど[Co(NH3)6]X3の形で置換される。これらの物質は鮮やかな黄色や橙色であるが、水への溶解度は物質によって大きく異なる。
調製
編集CoCl3は不安定であるため利用できない(Co3+が塩素を酸化してしまうほか、自身も不均化反応で分解してしまう)ので、[Co(NH3)6]Cl3は塩化コバルト(II)(英語版)を酸化して合成される。CoCl2をアンモニアおよび塩化アンモニウムで処理してから酸化する。酸化剤は過酸化水素または酸素を用い、活性炭を触媒とする[2]。この塩はM.E.フレミーによって報告された[3]。
メタノールに溶かしたアンモニアと酢酸アンモニウムを用いて、酢酸コバルト(II)を空気酸化することで、塩化物ではなく酢酸塩を作ることができる[4]。酢酸塩は非常に水に溶けやすく、水1Lあたり1.9 mol (20 °C)を溶かすことができる(塩化物は0.26 mol/L)。
用途
編集[Co(NH3)6]3+は構造生物学で、特に陽イオンによってリン酸骨格の三次構造が安定化されるDNAやRNAについて、X線やNMRで[5]でそれらの構造を解析するために用いられる[6]。 生体(英語版)では、対になるイオンはMg2+が多いが、重金属であるコバルト(あるいはPDB file 2GISのようなイリジウム)では異常散乱が起きるので位相問題が解決でき、電子密度図を得ることができる[7]。
脚注
編集- ^ Huheey, James E. (1983). Inorganic Chemistry (3rd ed.). p. 360
- ^ Bjerrum, J.; McReynolds, J. P. (1946). “Hexamminecobalt(III) Salts”. Inorganic Syntheses 2: 216–221. doi:10.1002/9780470132333.ch69.
- ^ Fremy, M. E. (1852). “Recherches sur le cobalt”. Annales de chimie et de physique 35: 257–312.
- ^ Lindholm, R. D.; Bause, Daniel E. (1978). “Complexes of Cobalt Containing Ammonia or Ethylene Diamine: Hexaamminecobalt(III) Salts”. Inorganic Syntheses 18: 67–69. doi:10.1002/9780470132494.ch14.
- ^ Rudisser, S.; Tinoco, I., Jr. (2000). “Solution structure of Cobalt(III)hexammine complexed to the GAAA tetraloop, and metal-ion binding to G.A mismatches.”. Journal of Molecular Biology 295: 1211–1232. doi:10.1006/jmbi.1999.3421. PMID 10653698.
- ^ Ramakrishnan, B.; Sekharudu, C.; Pan, B.; Sundaralingam, M. (2003). “Near-atomic resolution crystal structure of an A-DNA decamer d(CCCGATCGGG): cobalt hexammine interaction with A-DNA”. Acta Crystallographica D59: 67–72. PMID 12499541.
- ^ McPherson,, Alexander (2002). Introduction to Macromolecular Crystallography. John Wiley & Sons. ISBN 0-471-25122-4