キネシン
キネシン(英語: Kinesin)とは、真核生物の細胞質中に含まれるモータータンパク質の一種。酵母からラット、ヒトを含め広く存在するタンパク質の一群で、この中では最初に発見された conventional kinesin (遺伝子名kinesin-1)の研究がもっとも盛んに行われている。キネシンは主にATPを加水分解しながら微小管に沿って運動する性質を持ち、細胞分裂や神経軸索輸送などの細胞内物質輸送に重要な役割を果たしている。



構造 編集
キネシン分子の全体構造 編集
キネシンスーパーファミリーの分子構造は多様であるが、主なものは、分子量約12万の重鎖2本と分子量約6万の軽鎖2本からなる二量体である。重鎖はモータードメイン、ストーク、尾部(ここに軽鎖が結合する)からなる。モータードメインは通常アミノ酸配列の N 末端側にあり、ここで ATP を分解し微小管と結合する。ストークはコイルドコイル構造を持ち、2本の重鎖がねじれあってこの領域で結合している。尾部はさまざまな荷物(小胞や細胞内小器官など)と結合するため、多くのバリエーションがある。
分子形状は約80nmの棒状(というより、カイワレ大根のような形状)で、微小管との相互作用部位は重鎖N末端にあるATPアーゼ活性部位を持ち、微小管と結合する部位を持つ。このモータードメインの構造はミオシンやGタンパクと似ている。このモータードメインには、微小管の存在しないところでは通常ADPが結合しており、その解離は非常に遅いが、微小管によってその解離が1000倍以上速くなる。
キネシンの微小管上での移動は単分子でも可能で、微小管に結合すると1秒以上微小管に結合したままおおむね1μm程度移動することができる。
モータードメイン 編集
頭部はキネシンの特徴であり、そのアミノ酸配列は種々のキネシン間でよく保存されている。それぞれの頭部には2つの結合部位がある。1つは微小管結合部位であり、もう1つはATP結合部位である。ATPの結合と加水分解、ADPの放出は微小管結合部位の立体構造と頭部に対するネックリンカーの配向を変化させる。キネシンの運動が起こる。中央のβシートドメインおよびスイッチIおよびIIドメインを含む頭部のいくつかの構造は、2つの結合部位とネックドメインとの間の相互作用を媒介するものと考えられている。キネシンはATPの代わりにGTPを加水分解するGタンパク質と構造的に似ており、いくつかの構造要素、特にスイッチIドメインとスイッチIIドメインが共通している。
基本的な調節原理 編集
キネシンは基礎酵素活性が低く、微小管で活性化されると顕著になる傾向がある。さらに、キネシンスーパーファミリーの多くのメンバーは、尾部ドメインのモータードメインへの結合によって自己阻害される。そのような自己抑制は、カーゴまたはカーゴアダプターへの結合のような追加の調節を介して緩和することができる。
カーゴトランスポート 編集
細胞内では、ガスやグルコースなどの小分子は必要な場所に拡散する。細胞体で合成された大きな分子や、小胞のような細胞内構造物やミトコンドリアのような細胞小器官は、大きすぎて(また細胞質ゾルは非常に混み合っているので)目的地まで拡散できない。モータータンパクは細胞のまわりの大きな積み荷を目的地に運ぶ役割を果たす。キネシンはモータータンパク質であり、微小管に沿って一方向に歩くことによって積み荷を輸送する。その際、歩行の各ステップでアデノシン三リン酸 (ATP) 1分子を加水分解する。ATPの加水分解が歩行の各ステップを駆動し、放出されたエネルギーが頭部を次の結合部位へと前進させると考えられていた。しかし、キネシン頭部が前方に拡散した際に微小管に結合しようとすることで、積み荷が引っ張られるとする説も存在する。また、HIV等はキネシンを利用してフォールディング後にウイルス粒子を行き渡らせる。
キネシンスーパーファミリータンパクの働き 編集
キネシンスーパーファミリーには、ヒトおよびマウスにおいては45種類ものメンバーが存在することが知られている。この中には、微小管上をマイナス端からプラス端に移動するもの、逆にプラス端からマイナス端に移動するものの他、微小管の脱重合を促進するものも存在する。例えば、KIF2と呼ばれるキネシンは、主に微小管の脱重合に関与するといわれる。KIF5やKIF1同様微小管上を移動するが、微小管末端に到達した後、微小管からの解離に伴い微小管末端のチューブリンを微小管から切り離すことが知られている。
理論モデル 編集
分子モータータンパク質キネシンの多くの理論モデルが提案されている。 タンパク質構造の役割、ATPからのエネルギーが機械的仕事に変換される正確な方法、熱的ゆらぎが果たす役割に関する不確実性が残っていることを考えると、理論的研究には多くの課題がある。これはかなり活発な研究分野である。特にタンパク質の分子構造と実験的研究から得られたデータとの関連をより良くするアプローチが必要である。
単一分子の動力学はすでに十分に説明されているが、これらのナノスケールマシンは通常、大規模なチームで動作するようである。最近の実験的研究で、キネシンは微小管に沿って移動しながら、相互に作用し、その相互作用は短距離で弱い引力であることが示された(1.6±0.5 KBT)。開発された1つのモデルは、これらの粒子の相互作用 [38] を考慮に入れており、動的速度は相互作用のエネルギーに応じて変化する。エネルギーが正ならば、結合の生成速度 (q) は高くなり、結合の切断速度 (r) は低くなる。微小管への出入りの速度もエネルギーによって変化することがわかる(参考文献30の図1参照)。第2のサイトが占有されている場合、参入率はα*qとなり、最後から1つのサイトが占有されている場合、退出率はβ*rとなる。この理論的アプローチは、特に非常に大きな負エネルギーの極限の場合、このモデルに対するモンテカルロシミュレーションの結果と一致する。(またはTASEP)結果に対する通常の完全に非対称な単純な排除過程は、エネルギーを0にしてこのモデルから回復できる。
有糸分裂 編集
近年、微小管に基づく分子モーター(多くのキネシンを含む)が有糸分裂(細胞分裂)に役割を持つことが発見されている。キネシンは適切な紡錘体の長さに重要であり、前中期と中期には紡錘体内で微小管が離れて滑るのに関与し、後期には中心体で微小管マイナス端が脱重合する。 特に、キネシン5ファミリータンパク質は紡錘体内で微小管を引き離し、キネシン13ファミリーは微小管を解重合する。
キネシンの微小管上における運動の仕組み 編集
キネシンが、どのように微小管上を動くかについては、いくつかの説が唱えられている。ここでは、代表的な2つの説を示す。
Hand-over-Hand Model
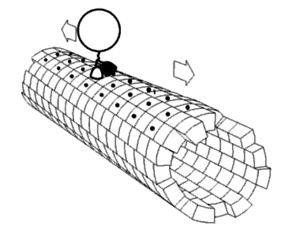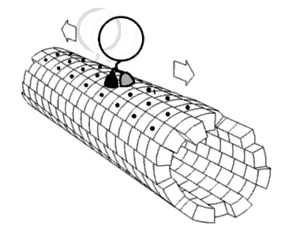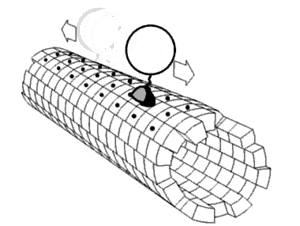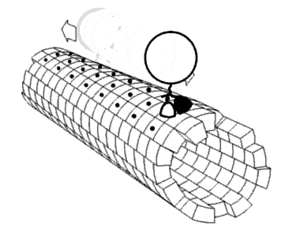
キネシンの2つのモータードメインが交互に、まるで歩くように、あるいはたぐり寄せるように、前に出て動くという説。その原動力になっているのは、ネックリンカー ((図1)付録の解説および(図2)参照)と呼ばれる領域がATP/ADPの結合解離に応じて前向きに折れ曲がったり離れたりを繰り返す運動ではないかと考えられている。
滑り説
滑り説は、キネシンが微小管上を滑るように移動するという説である。右に示した図が、キネシンの活性発現に関し重要といわれる領域の拡大図である。冒頭のキネシンの構造図でいうと、左下から見上げた形になる。
キネシンのモーター領域には、L9 からなるSwitch Iと呼ばれる領域と、Switch II clusterと呼ばれる L11-α4-L12 の領域が存在する。この2つの領域はATPの加水分解に際し、その構造を大きく変化させる。Switch IとSwitch IIのL11にはATPの加水分解に直接関与するアミノ酸残基が存在し、また、SwitchII領域は微小管結合部位となっているが、ATPの加水分解に際し、SwitchIIのL12の部分で、微小管を形成するタンパク質のE-hookと呼ばれる管表面に露出した環状の部分を順次つかみ換えて移動するらしいと考えられている。
なお、E-hookは微小管上におよそ4nmの間隔で存在する。(これは微小管の構成要素であるチューブリンの長さに等しい)一回のATP加水分解で8nm進み、1秒あたり100回以上繰り返す。