ベンゾジアゼピン
| ベンゾジアゼピン |
|---|
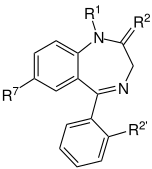
|
| ベンゾジアゼピン系の核となる骨格。 「R」の表記部分は、ベンゾジアゼピンの異なる 特性を付与する側鎖の共通部位である。 |
| ベンゾジアゼピン |
| ベンゾジアゼピンの一覧 |
| en:Benzodiazepine overdose |
| ベンゾジアゼピン依存症 |
| ベンゾジアゼピン薬物乱用 |
| ベンゾジアゼピン離脱症候群 |
| ベンゾジアゼピンの長期的影響 |
ベンゾジアゼピン(benzodiazepine)は、縮合したベンゼン環とジアゼピン環が中心となる化学構造をもつ、向精神薬である。 BZD、BDZ、BZP、BZ等と略記される。 この系統の初めての薬であるクロルジアゼポキシドは、1955年にレオ・スターンバックにより偶然発見され、1960年にホフマン・ラ・ロシュにより作り変えられたジアゼパムもまた1963年以来販売されている。


同種の効用を持つ以前の医薬品は、バルビツール酸系薬や非バルビツール酸系薬であり、1960年代にはベンゾジアゼピン系のクロルジアゼポキシド(日本ではコントールやバランスとして知られる)が登場し、以前の薬剤の危険性から置き換えられて用いられる様になった。 以上3種の薬剤は、1950年代〜1960年代にかけてトランキライザー(精神安定剤)として市販され、乱用および自殺に用いられた経緯があり、現在では1971年の国際条約である向精神薬に関する条約において、乱用の懸念のため国際的に厳重な管理下にあり処方は医師によってのみ行われる。各国が条約に批准したため、多くのベンゾジアゼピン系薬は日本の麻薬及び向精神薬取締法(麻薬取締法)における第三種向精神薬に指定され、また個別には麻薬取締法と重複して日本の薬事法において習慣性医薬品に指定されているものがある。 その後に、催眠用途の医薬品として、非ベンゾジアゼピン系が登場している。不安障害においても第一選択はSSRI系抗うつ薬であり、ベンゾジアゼピン系薬の位置づけは低下している[1]。
ベンゾジアゼピンは、GABAA受容体における神経伝達物質のγ-アミノ酪酸(GABA)の作用を強め、鎮静、催眠 (睡眠導入)、抗不安、陶酔、抗痙攣、筋弛緩の特性がある。 また、多くの短時間型ベンゾジアゼピンの高用量における応用薬理として、健忘-解離作用がある[2]。これらの特性は、不安、不眠症、激越、発作、痙攣、アルコール離脱症候群の治療や、医療的あるいは歯科的処置の前投薬に役立っている[3]。 ベンゾジアゼピンは、短時間型、中間型、長時間型の作用に分類される。短時間と中間型作用のベンゾジアゼピンは不眠症の治療に、長時間型のベンゾジアゼピンは不安の治療のために推奨されている。[4]
一般に短期間の使用であれば安全で有効であるが、時に認知障害と攻撃性や行動脱抑制のような奇異反応が生じる[5]。少数では、通常予想されるのとは反対の反応を示す。例えば、パニックの状態が、ベンゾジアゼピンを服用することでかなり悪化する場合がある[5]。 長期間の使用は、有害な精神的、身体的影響に関する懸念のため議論がある。ベンゾジアゼピン系には耐性、身体依存、また長期間の使用の後に断薬した場合に離脱症状を生じさせる傾向があるために、有効性に対する疑問が増加している[6][7]。ベンゾジアゼピン系の長期間の使用に伴う有害作用により悪化した身体や精神の健康が、ベンゾジアゼピンから離脱することにより改善されることがよくある[8][9]。 高齢者では、短期間また長期間の薬物有害反応に苦しむリスクが高く[8][10]、認知症のリスクの約50%の増加にも結びついている[11]。しかし認知症発症の前駆期を考慮すると、認知症のリスク増加とは関連していないことが分かっている[12]。さらに離脱症状が生じることが繰り返されれば、次第にキンドリング現象により、離脱時の不安感の増加や発作の閾値が低下するなど離脱症状が重篤化していく[13]。ベンゾジアゼピン系薬(またバルビツール酸系、アルコール)の離脱症状は、振戦せん妄(DT)により致命的となる可能性があるため、振戦せん妄の兆候の診断が必要である[14]。
妊娠中のベンゾジアゼピン系の使用には、安全性について懸念から議論がある。催奇性は大きくないが、少数の乳児において口唇口蓋裂の原因になるかどうかや、胎児期の曝露の結果として神経行動学的影響が発生するかどうかは不明である[15]。また、新生児薬物離脱症候群の原因になることが知られている。
ベンゾジアゼピンは、過量服薬によって危険な昏睡の原因になる。しかし、以前のバルビツール酸系よりもはるかに毒性が低く、単独で服用された場合の死亡は稀である。アルコールやオピエートのような他の中枢神経系の抑制剤と併用された場合には、毒性と致命的な過量服薬は増加する[16]。 ベンゾジアゼピン系は、他の乱用薬物との併用で摂取されていることも一般的である[17][18][19]。 さらに、すべてのベンゾジアゼピン系は高齢者に望ましくないビアーズ基準に含まれており、臨床業務において重要である。
医療用途
編集ベンゾジアゼピンは、鎮静、催眠、抗不安、抗てんかん、筋弛緩、健忘作用を有し[2][3]、アルコール依存症、発作、不安、パニック、興奮、また不眠症のような様々な適応がある。一般的に経口投与される。しかしまた点滴、筋肉注射、直腸からの形で投与される[20]。一般的に、ベンゾジアゼピン系は、幅広い症状に対して短期間において、忍容性が良好で安全で有効な薬剤である[21][22]。それらの作用に対して耐性が形成され、依存症のリスクもあり、断薬により離脱症状が生じることがある。精神運動、認知、あるいは記憶障害のような、長期的に使用した場合に起こりうる他の作用と相まったこれらの要因は、長期的な使用の妥当性を制限する[23][24]。長期的な使用による影響や乱用は、認知障害、うつ病や、不安を引き起こしたり、悪化させる傾向がある[8][10]。乱用リスクがあるため、よく知らない外来患者には処方すべきではない[25]。
アメリカ食品医薬品局(FDA)はベンゾジアゼピンの長期処方について規制していない。しかし2020年9月23日、ベンゾジアゼピン薬のブラックボックス警告更新要請 (日本語訳)がアナウンスされ、ベンゾジアゼピン投与開始からわずか数日~数週間で身体依存が形成される例があるとし、中止にあたっては患者ごとに漸減計画を作成し投与量を徐々に減らす漸減テーパー法を用いて深刻な離脱症状を回避するよう警告している。さらに、乱用(abuse)、誤用(misuse)、および身体依存(Physical dependence)の区別を文書内で明確化している。
ロシュ社では、同社の製品であるバリウム(ジアゼパム)の添付文章にて、ベンゾジアゼピンを精神病の治療には推奨していない。ベンゾジアゼピンの使用は自殺の可能性があるため、単独で不安の治療に使用してはならないとしている[26]。
パニック障害
編集有効性、忍容性、そして素早い抗不安作用から、パニック障害に併存する不安の治療に対して、ベンゾジアゼピンは頻繁に用いられてきた[27]。しかし、パニック障害に対するベンゾジアゼピンの長期的な使用という点では、専門団体の間に意見の不一致がある。ベンゾジアゼピンは長期的には有効ではないというものから[28]、治療抵抗性の症例に対して選択肢として確保すべきであるとか[29]、長期的にも選択的セロトニン再取り込み阻害薬(SSRI)と同様に有効であるというものまで[30]様々な見解がある。
アメリカ精神医学会(APA)のガイドライン[30]は、一般的にベンゾジアゼピンの忍容性は良好であり、パニック障害の初期治療に用いられることについては、多くの対照試験に強く支持されていると言及している。APAは、他を超える定着したパニック障害治療を推奨するための十分な証拠がないと述べている。ベンゾジアゼピン、SSRI、セロトニン・ノルアドレナリン再取り込み阻害薬(SNRI)、三環系抗うつ薬や、心理療法からの治療の選択は、患者の既往、好みやほかの個人的な特徴に基づくべきである。選択的セロトニン再取り込み阻害薬は、多くのパニック障害を有する患者のための薬物療法の最良の選択である可能性が高いが、ベンゾジアゼピンは頻繁に用いられ、またいくつかの研究は、これらの薬がいまだにSSRIよりも頻繁に用いられていることを示唆している。ベンゾジアゼピンの一つの利点は、不安症状を抗うつ薬よりも非常に早く軽減することであり、それゆえに迅速な症状の管理が重要である患者においては好ましいかもしれない。しかし、この利点はベンゾジアゼピン依存症の進行の可能性によって打ち消される。APAは抑うつ症状を伴ったり、薬物乱用の既往を有する患者にベンゾジアゼピンを推奨していない。APAのガイドラインは、一般的に、パニック障害の薬物療法は少なくとも1年の継続が推奨され、臨床経験が再発防止のためのベンゾジアゼピンによる治療の継続を裏付けていることに言及している。ベンゾジアゼピンによる耐性と離脱についての主な懸念を取り上げたが、ベンゾジアゼピンを長期間使用する患者において使用量が有意に増加していくという証拠はない。ベンゾジアゼピンを服用している多くの患者において、何年にもわたり効力が保たれている。[30]
英国国立医療技術評価機構(NICE)によるガイドラインでは、異なった手法を用いたシステマティック・レビューが行われ異なった結論に達している。ここでは偽薬対照ではない研究の精度を疑問視している。そして、偽薬対照試験の調査結果に基づき、耐性と身体依存が急速に形成され、6週間を超える使用後には反跳性不安(リバウンド不安)を含む離脱症状を生じさせるため、2〜4週間を超えるベンゾジアゼピンの使用は推奨されていない。[28][31]それでもベンゾジアゼピンは不安障害の長期間の治療に処方され続けているが、明確に抗うつ薬と心理療法が一次治療に推奨され、二次あるいは三次治療の選択肢として抗てんかん薬のプレガバリンが示され、長期間の利用に適切である[32]。NICEは、対人恐怖の有無に関わらずパニック障害に対するベンゾジアゼピン系の長期間の使用は承認しておらず、長期間の有効性がなく、そのため臨床ガイドラインにおいて推奨していないことに言及している。認知行動療法のような心理療法を、パニック障害に対する一次選択治療として推奨している。ベンゾジアゼピンの使用は、それらの心理療法による治療利益を妨げることが判明している。[28]
ベンゾジアゼピンは通常経口投与される。しかし、極めてまれにロラゼパムやジアゼパムがパニック発作の治療のために、静脈注射されることがある[20]。
全般性不安障害
編集ベンゾジアゼピンは、短期間における全般性不安障害(GAD)の管理においては堅牢な効果があるが、長期的な全体的な改善に有効であることは示されていない[33]。英国国立医療技術評価機構(NICE)のガイドラインに従えば、ベンゾジアゼピンは、必要であればGADの緊急的な管理に用いることができる。しかしながら通常2〜4週を超える投与は推奨されない。NICEがGADの長期的な管理のために推奨する医薬品は抗うつ薬のみである[34]。
同様に、カナダ精神医学会(CPA)では、アルプラゾラム、ブロマゼパム、ロラゼパム、ジアゼパムなどのベンゾジアゼピンは、2種類の異なる抗うつ薬が奏効しなかった場合の二次選択としてのみ推奨している。とはいえ、それらは第二選択薬であり、ベンゾジアゼピンは重度の不安や動揺を緩和するための限られた期間の使用に限定される。CPAのガイドラインは、4〜6週間後のベンゾジアゼピンの効果は偽薬と同じ域にまで減衰する可能性があり、またGADの中核症状の反すう不安の軽減においては、抗うつ薬より有効性がないとしている。しかし、いくつかの症例では、抗うつ薬に追加したベンゾジアゼピンの長期的な投薬は正当であることもある[35]。
同様に、王立オーストラリア総合医学会(RACGP)では、GADへの第一選択肢は認知行動療法(CBT)であり、薬物療法を行うのであればSSRI/SNRIを第一選択肢とし、BZDは多くの場合は深刻か治療抵抗性である場合に限られるとしている[36]。
不眠症
編集ベンゾジアゼピンは不眠症の短期間の治療には有用であるが、第一選択肢は認知行動療法(CBT)とすべきであり、処方は依存や有害作用といったリスクと利益をよく検討したうえで行うべきである[37]。依存症のリスクのため2〜4週間を超えた使用は推奨できない[37]。ベンゾジアゼピンは断続的に最小有効量で用いることが望まれる。これらは入眠潜時に費やす時間を減らし、睡眠時間を延ばし、通常は覚醒を弱めることで睡眠に関連した問題を改善する[38][39]。
しかし、浅い眠りを増やし深い睡眠を減らすことによって睡眠の質を悪化させる。ベンゾジアゼピンを含む睡眠薬の他の欠点として、その作用に対する耐性が予想されることや、反跳性不眠、徐波睡眠の減少、反跳性の不眠や長期にわたる不安や動揺といった特徴のある離脱期間が挙げられる。[40][41]不眠症の治療に対して承認されたベンゾジアゼピンの一覧は、多くの国の間でも似たり寄ったりであるが、公式に指定されている不眠症の治療に処方される一次選択の睡眠薬としてははっきりとした違いがある[39]。ニトラゼパムやジアゼパムのような長時間型のベンゾジアゼピンは翌日まで効果が持ち越すため、通常は推奨されない[38]。アメリカで不眠症に対して適応のあるベンゾジアゼピンは、半減期の短いエスタゾラム、トリアゾラムやテマゼパムなどである[39]。
新しい非ベンゾジアゼピン系睡眠薬(Z薬)が、短時間型のベンゾジアゼピンよりも優れているかについては明確ではない。医薬品のこれらの2つのグループの有効性は同様である[38][41]。米国医療品質研究機構(AHQR)によれば、ベンゾジアゼピン系の副作用は非ベンゾジアゼピン系よりも約2倍の頻度であることを、間接比較が示している[41]。一部の専門家は、不眠症に対する一次選択の長期的な治療として、優先的に非ベンゾジアゼピン系を用いることを提案している[39]。しかし英国国立医療技術評価機構(NICE)は、Z薬を優遇する確固たる証拠を発見できなかった。NICEのレビューは、長時間型のベンゾジアゼピンと比較された短時間型のZ薬の臨床試験が不適切であることを指摘した。短時間型のZ薬と、適切な用量の短時間型のベンゾジアゼピンとを比較した試験は存在しない。このことから、NICEは費用と患者の好みに基づいて睡眠薬を選択することを推奨している[38]。王立オーストラリア総合医学会(RACGP)は効果と注意事項について、BZDとZ薬は同じであるとしている[42]。
高齢者においては、他の治療が有効でなかった場合を除き、不眠症の治療にベンゾジアゼピンを使用すべきではない[43]。ベンゾジアゼピンを用いる場合、すべての高齢患者の間で、運転する患者における交通事故や、同様に転倒と腰部骨折の発生率が2倍になることを示す証拠を含めた、有害なリスクの増加について、患者、介護者、また医師は話し合うべきである[43]。
発作
編集持続的な痙攣性のてんかん発作は、救急医療が必要とされる状態であり、通常は強い抗てんかん薬である即効性のベンゾジアゼピンの投与によって効果的に対処できる[44]。病院環境では、クロナゼパム、ロラゼパムやジアゼパムの静脈投与が第一選択薬剤となり、クロナゼパムには他より強い抗痙攣作用があり、ロラゼパムは作用開始が速く、ジアゼパムは作用時間が長い。(日本においては、ジアゼパムにのみ注射薬が存在する)通常の環境では、静脈内投与は実用的ではないため、坐剤による直腸からのジアゼパム投与や、(最近では)ミダゾラムの鼻腔あるいは口腔粘膜吸収が用いられ、ミダゾラムのほうが投与がたやすく社会的に許容されやすい[45][46]。
ベンゾジアゼピンが最初に導入されたとき、それはすべての種類のてんかん治療に対して積極的に採用された。しかし、眠気と耐性が継続使用のための問題となり、現在では長期的なてんかん治療の一次選択ではない。[47]クロバザムは、オランダやベルギー、フランスで一般的であり、国際的にてんかんの専門病棟において広く使用されている[47]。アメリカでは2011年に使用が承認された。イギリスでは、クロバザムとクロナゼパムの両方が多くの種類のてんかん治療の二次選択薬剤である。[48]クロバザムはまたごく短期的な発作の予防と、月経てんかんにおいて有用である[47]。てんかん治療に対する長期間の使用後の断薬については、反跳性(リバウンド)の発作のリスクがあるため注意が必要である。従って、投与量を6か月以上かけて徐々に漸減すべきである。[46]
アルコール離脱
編集クロルジアゼポキシドは、アルコール解毒によく用いられるベンゾジアゼピンだが[49]、 ジアゼパムも代わりに用いられることがある。共に断酒をしようとする患者の解毒に用いられ、ベンゾジアゼピン系薬に対する耐性と依存の形成のリスクを減らすために、短期間において処方される[50]。これら半減期の長いベンゾジアゼピン系薬は解毒を耐えやすくし、危険なアルコール離脱の作用を生じにくくする。一方、短時間型ベンゾジアゼピンは突破性発作(英語: breakthrough seizure)につながる可能性があり、外来患者の解毒には推奨できない。オキサゼパムやロラゼパムは、抱合を介して他のベンゾジアゼピン系とは異なって代謝されるため、特に高齢や肝硬変といった薬物が蓄積するリスクがある患者によく用いられる。[51][52]
ベンゾジアゼピンはアルコール離脱症候群の管理に[53]、とりわけ危険な発作の合併や振戦せん妄の予防と治療のために優先される[54]。ロラゼパムは予想通りに筋肉吸収ができる唯一のベンゾジアゼピンであり、急性発作の予防管理において効果的である[55](日本にはロラゼパムの注射薬はない)。
不安
編集ベンゾジアゼピンは時に急性不安の治療に用いられ、すぐに奏功しほとんどの患者の症状を緩和する[28]。しかし、耐性と依存症のリスクがあるため長期的な有効性はなく、2〜4週以上の使用は推奨されない。他の薬物療法と比較して、ベンゾジアゼピンでは中断時の症状の再発率が約2倍である。全般性不安障害の長期治療には、心理療法や他の薬物療法が推奨される。抗うつ薬はより高い寛解率を持ち、一般的に短期的にも長期的にも安全で有効である[28]。
その他の適応症
編集ベンゾジアゼピンはまた、以下のような様々な状態に対して処方されている。
- ベンゾジアゼピンは強力な筋弛緩特性が知られており、筋肉の痙攣の治療に有用である[56][8]。しかしながらたいてい筋弛緩効果には耐性が形成される。バクロフェン[57]またはチザニジンが時々ベンゾジアゼピン系の代替として使用される。チザニジンはジアゼパムやバクロフェンと比較して優れた忍容性をもつことが判明している。[58]
- ベンゾジアゼピンは人工呼吸時の挿管の苦痛を取り除くことができる。しかし呼吸抑制を起こすことがあるので、過量投与に対応できる施設で用いることが望ましい[59]。
- ベンゾジアゼピンは手術前の患者の不安を和らげるために用いることがある。また、健忘を起こすことにより、手術に関する不快な記憶を忘れることができる[60]。
- ベンゾジアゼピンは幻覚剤毒性による急性のパニックの治療にも用いられる[61]。急性の興奮を鎮めるため、(可能な場合には必要に応じて)筋肉内注射で用いる[62]。
- 抗精神病薬は、一般的にせん妄の一次選択薬剤である。しかし、せん妄の原因がアルコールや鎮静催眠薬の離脱である場合には、ベンゾジアゼピンが第一選択である[63]。
- 強迫性障害に対しては効果がないと言われていたが、小規模な研究で有効性が示された例がある[64]。ベンゾジアゼピンは他の治療抵抗性の症例では選択肢となり得る[65]。
- せん妄の治療には抗精神病薬が第一選択肢であるが、アルコール性または催眠鎮静薬の離脱症状としてのせん妄にはベンゾジアゼピンが第一選択薬である。
- 低用量のベンゾジアゼピンが電気痙攣療法の副作用緩和に有効であるとのエビデンスがいくつかある[66]。
副作用
編集ベンゾジアゼピンの最も一般的な副作用は、鎮静作用と筋弛緩作用に関するものである。具体的には眠気、めまい、覚醒と集中力の欠如などがある。姿勢制御の欠如によって転倒や怪我を招くことがあり、とりわけ高齢者に多い[68][69][70] もう一つの問題は運転操作の支障であり、交通事故の可能性を増加させる。[71][72] 性欲の減衰や勃起の問題は一般的な副作用である。抑うつや脱抑制が起こることがある。静脈注射の場合は、低血圧や呼吸抑制が起こることがある。[68][69]少数のケースでは、吐き気、食欲の変化、目のかすみ、混乱、幸福感、離人症、悪夢などがある。非常にまれなケースで肝毒性がある[73][74]
奇異反応
編集奇異反応として、てんかん発作[75]、攻撃性、暴力、衝動性、易刺激性、自殺行動などの奇異反応が時に生じる。 これらの反応は、脱抑制の影響、それに続く、社会的に容認できない行動の制御不能と解釈されている。奇異反応の一般集団における発生率は1%以下であり、偽薬と同等の稀なものである。[5][76]しかし、娯楽的乱用や、境界性パーソナリティ障害の患者、子供、高用量の投与計画下の患者ではより高い頻度で生じる[77][78]。これらの集団においては、衝動の制御の問題が、おそらく脱抑制における最も重要な危険因子である。学習障害や神経障害もまた大きなリスクである。脱抑制に関するほとんどの報告は、高力価のベンゾジアゼピンの高用量に関している。[76]奇異反応は慢性的なベンゾジアゼピンの使用においても生じる[79]。
認知的な作用
編集ベンゾジアゼピンの短期的な使用は、認知機能に様々な悪影響を及ぼし、最も顕著なことは新たな記憶の形成と統合を妨げたり、完全な前向性健忘症を誘発することである[68]。しかし研究者らは、長期投与の影響に関する逆の意見を持っている。ある見解では、多くの短期間の影響が長期的に続く上にさらに悪化し、ベンゾジアゼピンをやめても解消しないということである。別の見解は、慢性的なベンゾジアゼピン使用者での投与後の短期間にのみ生じる認知障害とか、あるいは不安障害がその原因であると主張する。
決定的な研究はないが、前者については、13の小規模研究の2004年のメタ・アナリシスの支持に裏付けられている[80][81]。このメタ・アナリシスは、ベンゾジアゼピンの長期的な使用が、認知のすべての領域において、中等度から大きな有害な影響に結びついていることを見出しており、視空間記憶が最も一般的に発見された障害であった。一部のほかの障害は、知能指数(IQ)、視覚運動協調、情報処理、言語学習と集中力の低下である。メタ・アナリシスの執筆者[80]、また後の評論[81]は、ほとんどは離脱専門病院から被験者を獲得しているためこのメタ・アナリシスの妥当性は制限されると注記している。併用薬、アルコールの使用、また精神障害は明示されていない。また、含まれた研究のいくらかは、離脱期間中に認知を測定している。
胎児への影響
編集アメリカ食品医薬品局(FDA)による胎児危険度分類では、ベンゾジアゼピンは、胎児への有害事象への可能性がある、カテゴリDまたはXに分類されている。いくつかの研究の論争での結論で、妊娠中の胎児に口蓋裂(0.06〜0.07%まで)のリスク増加と関連していると結論づけた。
この節の加筆が望まれています。 |
長期的影響
編集FDAはベンゾジアゼピンの長期処方についてなにも規制していない。ベンゾジアゼピンの長期的悪影響には、精神的、身体的機能の劣化があり、時間とともに増加する傾向にある。万人に該当することではないが、長期使用では問題が発生するとされる。副作用には認知障害だけでなく、情動と行動の問題、混乱の感情、建設的思考困難、性欲減退、広場恐怖症と社会恐怖の損失、不安や抑うつの増加、楽しみの追及と利益への関心の喪失、感情や経験の表現喪失がある。[9][82]さらに、自分と周囲環境との関係について認識変化がおこる可能性がある[81]。
複数の研究結果を分析したメタアナリシスは、認知症とベンゾジアピンの使用とが関連していることを見出している[83][84]。
眼瞼痙攣は、まぶしい、目が開かないといった症状を呈し、ベンゾジアゼピン系など同類の薬剤の特に長期使用によって起こる可能性があり、ベンゾジアゼピン眼症として提案されている[85]。
離脱症候群
編集処方が2週間未満の者については直ちに断薬が可能であるが[86]、長期処方者については困難となりえる。半減期の短い薬剤ほど依存性が高くなり、症状発現率40%との報告もある。高齢者ほど出現頻度が高く、また4か月以上の長期服用時に出現することが多い。半減期の長短にかかわらず常用量でも依存や反跳症状を生じる可能性が最近知られるようになった。1ヶ月の連用で約半数が依存形成され断薬が困難になる[87]。離脱の最も一般的な身体的症状は、筋肉の緊張、衰弱、痙攣、痛み、インフルエンザ様症状(発汗や震え)、(足などが)痺れてぴりぴりする感覚など。最も一般的な精神的離脱症状は、不安とパニック障害、不穏、食欲不振、頻脈、視力障害、視覚障害、口渇などがあり、耳鳴り、眠気など。それから離人感(周囲が現実ではないと感じる)。知覚の障害は比較的一般的であり、尋常性聴覚から光恐怖症、感覚異常までの範囲である。これらの症状は特徴的ではないが、ベンゾジアゼピン離脱の特徴である。発作は非常に一般的。特に、いきなり断薬した場合には。重度の離脱症状には、妄想思考、幻覚、脱個体化、および退行性せん妄が含まれる[87]。
耐性・依存と離脱
編集ベンゾジアゼピン系薬物の慢性的な使用における主な問題は、耐性と身体依存の形成である。耐性は薬理作用の減少として生じ、ベンゾジアゼピンの鎮静、催眠、抗てんかん、また筋弛緩作用に対して比較的急速に形成される。抗不安作用への耐性はよりゆっくりと形成され、4〜6か月以上の継続的な使用において有効性が継続するという証拠ほとんどない。[8]一般に、健忘作用に対する耐性は生じない[88]。しかし、抗不安作用に対する耐性については議論があり、ベンゾジアゼピンが効力を保つといういくらかの証拠と[89]、高い頻度で耐性が生じることを示す論文のシステマティック・レビューによる反証や[21][28]、長期的な使用により不安が悪化するといういくつかの証拠が存在する[8]。いくらかの証拠は部分的な耐性は生じないことや、記憶障害は投与から90分以内であることを示唆している[90]。
離脱症状の管理
編集ベンゾジアゼピン系薬からの離脱による最も多い症状は、不眠、消化器問題、震え、恐怖、激越、筋痙攣である[90]。それほど多くはないが易刺激性、発汗、離人症、現実感喪失、刺激への過感受性、抑うつ、自殺行動、精神病、発作、振戦せん妄が生じることもある[91]。重篤な症状は、たいてい突然あるいは急速すぎる離脱によって生じる。突然の断薬は危険であるため、徐々に減量する処方計画が推奨される[7]。WHOのガイドラインでは、離脱は長期作用型のベンゾジアゼピンに置換し8-12週間かけて行うとしている[25]。
症状は徐々に減量している期間中にも生じる可能性があるが、一般的にあまり重症にはならない。また一部では断薬後も何カ月も遷延化した離脱症状が続く[92]。離脱症状を経験した患者の約15%は顕著な遷延性離脱症候群(protracted withdrawal syndrome)を経験し、それは何ヶ月も、場合によっては1年以上にわたり持続する[86]。長期化する症状は、離脱の最初の数ヶ月に見られるものと似ているが、たいていは重篤な急性離脱症状の下位の水準である。このような症状は時間と共に徐々に弱まり、最終的に完全に消失する[93]。
ベンゾジアゼピンの離脱は重篤でトラウマになるような離脱の原因になると患者も医師も噂するが、しかしその大部分は離脱の経過が不適切に管理された場合である。急速すぎる離脱は、離脱症状の重症さを増すことにつながり失敗率も上げる。個々に合わせゆっくりかつ徐々に離脱すること、また必要であれば心理的な支援が提供されれば、離脱を管理する方法として最も効果的である。離脱の完了に必要な期間については、4週間から数年間までの幅広い意見がある。6ヶ月未満の目標が提案されているが[7]、しかしベンゾジアゼピンの種類と服用量、処方の理由、生活習慣、性格、環境的なストレス、得られる支援の量といった要因によって、離脱には1年かそれ以上を要することもある。[8][94]
身体的依存を、等価換算した用量のジアゼパム(セルシン)に移行することが、離脱の管理として最良である。なぜならジアゼパムは全てのベンゾジアゼピンの中で最も長い半減期であり、長時間作用の活性代謝産物となって代謝され、効果の弱い錠剤の種類もあり、これをより細かな用量へと4分割することもできる。[95]さらに液剤もあり、さらに細かく減量できる[7]。クロルジアゼポキシド(コントール)も長い半減期をもち長時間作用の活性代謝産物にもなるため、替わりに用いることができる[95][96]。
非ベンゾジアゼピン系はベンゾジアゼピン離脱期間中には禁忌である。ベンゾジアゼピンと交差耐性があり依存を引き起こすためである。[8]アルコールにもベンゾジアゼピンとの交叉耐性があり、毒性もより大きいため、依存が置き換わってしまうことを避けることへの注意が必要である。離脱期間中は、できればフルオロキノロン系の抗生物質を避けるのが最善である。それはベンゾジアゼピンを結合部位から外してGABA機能を減少させ離脱症状を悪化させることがある。[95]抗精神病薬は、ベンゾジアゼピン離脱時(その他の中枢神経抑制剤の離脱状態においても)には推奨できない。特に注意が必要なのはクロザピン、オランザピン、あるいは低力価のクロルプロマジンといったフェノチアジン系である。それらは発作閾値を下げ、離脱の影響を悪化させるため、用いる場合は細心の注意が必要である。[97]
長期間のベンゾジアゼピン使用者の離脱は、多くの場合有益である[79]。ベンゾジアゼピン長期服用者の離脱は一般的に身体・精神の健康の改善につながる。これは高齢者において顕著である。いくつかの長期利用の報告がベンゾジアゼピンの継続的な利益を報告しているが、これは離脱の影響が抑えられているためである可能性がある。[8][9]
過剰摂取
編集ベンゾジアゼピンは、以前のバルビツール酸系薬よりも過剰摂取において、はるかに安全であるがまだ過剰摂取の際には問題となる[16]。単独で過剰摂取された場合には、重篤な合併症の原因になることはまれである[99]。イギリスにおける統計では、単一の薬剤によるすべての中毒死の3.8%をベンゾジアゼピンが占めている[17]。これはアメリカでも同様の3.7%であるが[100]、併用の場合には著しい毒性が生じる[18][101][102]。併用では、アメリカでは薬物に起因する死亡の第2位の種類となる[100]。高齢者はベンゾジアゼピンの副作用に対してより敏感で、長期的な使用から中毒が生じることがある[103]。高齢者では、大量ではない一般的な常用量で過剰摂取となり致命的となる場合がある[104]。ベンゾジアゼピン過剰摂取の症状を挙げる、眠気、ろれつが回らない、眼振、低血圧、運動失調、昏睡、呼吸抑制、心停止[102]。
フルマゼニルはベンゾジアゼピンを無効にする薬剤である。解毒剤として用いられるが、再鎮静(再昏睡)や発作のリスクが高いため規定として用いるのは推奨できない[105]。326人の被験者を用いた二重盲検の偽薬対照試験では、フルマゼニル使用後に4人が重篤な有害事象を起こし、61%は再鎮静した[106]。その使用には多くの禁忌がある。それはベンゾジアゼピンの長期間の使用歴がある上に発作閾値を低下させたり不整脈を起こす物質を摂取していたり、バイタルサインが異常な場合である[107]。ある調査では、ベンゾジアゼピン過剰摂取を呈する患者の10%だけが、フルマゼニル投薬の適切な対象であった[108]。
作用機序
編集中枢神経系では神経伝達物質として、アミノ酸が多く分布している。主な神経作用性のアミノ酸としては興奮アミノ酸であるグルタミン酸、抑制アミノ酸であるGABAが有名である。グルタミン酸受容体(ナトリウム、カルシウムイオンチャネル)としてはイオンチャネル型受容体であるAMPA受容体、NMDA受容体、カイニン酸受容体がよく知られており、代謝型グルタミン酸受容体としてはmGluRが知られている。GABA受容体ではイオンチャネル型であるGABAA受容体(クロライドイオンチャネル)とGタンパク質共役受容体であるGABAB受容体が知られている。
GABAA受容体には、リガンドであるGABA結合部位の他に、バルビツール酸系結合部位、ベンゾジアゼピン結合部位、糖質コルチコイド結合部位、ペニシリン結合部位、フロセミド結合部位、フルマゼニル結合部位が知られており、GABAとの反応性の調節を行っている(ペニシリンがGABAアンタゴニストのように振る舞うのはこのためである)。
ベンゾジアゼピン系はGABAA受容体と結合するとチャネルの開口頻度を増加させる。バルビツール酸系と異なり、開口時間を延長せず、高用量負荷してもアゴニスト活性をもたない。その点でバルビツール酸系よりも安全性が高いと考えられ、抗不安薬、睡眠薬、抗てんかん薬、筋弛緩薬として使用される。ベンゾジアゼピンがクロライドチャネルの開口頻度をあげるメカニズムとしては、GABAとGABAA受容体との結合親和性を高めるためと考えられている。言い換えると、GABAの濃度―作用曲線を左にシフトすることとなる。
GABAA受容体の主な作動薬といえば、バルビツール酸系とベンゾジアゼピンであるが、バルビツール酸系はGABAの最大効力をあげるのに対して、ベンゾジアゼピンは用量効力をあげると考えられている。
ベンゾジアゼピン受容体には3つのサブタイプが知られている。それは中枢性のω1、ω2および末梢性のω3である。ほとんどのベンゾジアセピンがω1、ω2を区別しない。ω1が鎮静に関わり、ω2が認知、記憶、運動機能に関与すると考えられているが明らかになっていない。完全アゴニストがベンゾジアゼピン受容体の占有率に応じて、抗不安、抗痙攣、鎮静、健忘、運動失調、筋弛緩の順に発現すると考えられ、副作用が選択に出現しない部分アゴニストの開発が急がれていた。その結果、ゾピクロン(アモバン)やゾルピデム(マイスリー)といった非ベンゾジアゼピン系睡眠薬が開発された。これらはω1には作用するものの、ω2には作用しないため鎮静作用がほとんどで、抗不安作用、抗痙攣作用、筋弛緩作用は弱くなっている。ベンゾジアゼピンの拮抗薬としてはフルマゼニル(アネキセート)が有名である。インバースアゴニスト(受容体の基礎活性を抑制する)としてはプロプラノロールやアトロピンが知られている。
薬物動態学
編集ベンゾジアゼピンは消失半減期によって3つのグループのいずれかに区分できる。 いくつかのベンゾジアゼピンは長時間作用の活性代謝物を持っている。ジアゼパムやクロルジアゼポキシドなどがあり、デスメチルに代謝されている。デスメチルジアゼパムは、30-200時間の半減期で、フルラゼパムは40-250時間の半減期を持ち、デスアルキルフルラゼパムの主要活性代謝物である。これらの長時間作用型の代謝物は部分アゴニストである。[4]
- 短時間作用型の化合物は1-12時間の半減期である。就寝前に服用すれば翌日への持ち越し効果は少ない。中止によって反跳性不眠(リバウンドの不眠症)が発生する可能性がある。翌日の反跳性不安などの昼間の離脱症状を引き起こす可能性がある。例としてはブロチゾラム、ミダゾラム、トリアゾラム。(ブロチゾラムは、厳密にはベンゾジアゼピンではなく、チエノジアゼピンに分類される)
- 中間型の化合物は、12-40時間の半減期を持つ。催眠薬として使用する場合、一日の前半にいくつかの持ち越し効果があるかもしれない。反跳性不眠は長時間作用型よりも、中間作用型の中止のほうがより一般的である。例としては、アルプラゾラム、エスタゾラム、フルニトラゼパム、クロナゼパム、ロルメタゼパム、ロラゼパム、ニトラゼパムがある。
- 長時間作用型の化合物は、40-250時間の半減期を持っている。高齢者と深刻な肝機能障害者における蓄積のリスクがある。しかし反跳現象と離脱症候群の深刻さは少ない。例としてはジアゼパム、クロラゼプ酸、クロルジアゼポキシド、フルラゼパム、クアゼパムがある。
| 一般名 | 製品名 | 適応症 | DDD [注釈 1] | 作用時間 |
|---|---|---|---|---|
| ブロチゾラム | レンドルミン | 不眠症・麻酔前投薬 | 0.25 mg | 短時間作用型(3-8時間) |
| ミダゾラム | ドルミカム | 麻酔前投薬・全身麻酔・鎮静 | 15 mg | |
| トリアゾラム | ハルシオン | 不眠症・麻酔前投薬 | 0.25 mg | |
| エチゾラム | デパス | 不安・緊張・不眠症 | 0.5 mg | |
| アルプラゾラム | ソラナックス、コンスタン | 不安・緊張・抑うつ・睡眠障害 | 1 mg | 中時間作用型(10-20時間) |
| エスタゾラム | ユーロジン | 不眠症・麻酔前投薬 | 3 mg | |
| フルニトラゼパム | サイレース | 不眠症・麻酔前投薬 | 1 mg | |
| クロナゼパム | ランドセン、リボトリール | 小型(運動)発作・精神運動発作・自律神経発作 | 8 mg [注釈 2] | |
| ロルメタゼパム | エバミール、ロラメット | 不眠症 | 1 mg | |
| ロラゼパム | ワイパックス、ユーパン | 不安・緊張・抑うつ | 2.5 mg | |
| ニトラゼパム | ベンザリン | 不眠症・麻酔前投薬・異型小発作群・焦点性発作 | 5 mg | |
| クロチアゼパム | リーゼ | 不安・緊張・心気・抑うつ・睡眠障害・めまい・ 肩こり・食欲不振・麻酔前投薬 |
- | |
| ニメタゼパム | - | 不眠症 | - | |
| ブロマゼパム | レキソタン、セニラン | 不安・緊張・抑うつ・強迫・恐怖・睡眠障害・麻酔前投薬 | 10 mg | |
| ジアゼパム | セルシン、ホリゾン | 不安・緊張・抑うつ・筋痙攣・疼痛・麻酔前投薬 | 10 mg | 長時間作用型(1-3日) |
| クロラゼプ酸 | メンドン | 不安・緊張・焦躁・抑うつ | 20 mg | |
| クロルジアゼポキシド | コントール、バランス | 不安・緊張・抑うつ | 30 mg | |
| クロキサゾラム | セパゾン | 不安・緊張・抑うつ・強迫・恐怖・睡眠障害・術前の不安除去 | - | |
| フルラゼパム | ダルメート | 不眠症・麻酔前投薬 | 30 mg | |
| クアゼパム | ドラール | 不眠症・麻酔前投薬 | 15 mg | |
| ロフラゼプ酸エチル | メイラックス | 不安・緊張・抑うつ・睡眠障害 | 2 mg | 超長時間作用型(3日以上) |
| フルトプラゼパム | レスタス | 不安・緊張・抑うつ・易疲労性・睡眠障害 | - | |
| クロルジアゼポキシド | コントール、バランス | 不安・緊張・抑うつ | 30 mg | |
| メダゼパム | レスミット | 不安・緊張・抑うつ | 20 mg |
薬物相互作用
編集それぞれのベンゾジアゼピンは、異なった薬物相互作用を持つ。しかし代謝経路によってベンゾジアゼピンは大きく2つのグループに分けられる。主なグループはシトクロムP450で代謝されるもので、他の薬物と相互作用をもたらす可能性が大きい。もう一方のグループはグルクロン酸抱合で代謝されるものである。これにはロラゼパム、オキサゼパム、テマゼパムなどがあり、一般的に相互作用は小さい[109]。
経口避妊薬、一部の抗生物質、抗うつ薬、抗真菌剤など多くの薬剤は、肝臓のシトクロム酵素を阻害する。それらはCYP450で代謝されるベンゾジアゼピンの割合を減らし、過度の薬物の蓄積と副作用の増加を引き起こすことがある。 対照的に、シトクロムP450酵素を促進する薬物、セントジョーンズワート、抗生物質のリファンピシン、抗てんかん薬のカルバマゼピンやフェニトインなどは、ベンゾジアゼピンの排出を加速させ、作用を減少させる[110][111]。 ベンゾジアゼピンをアルコール、オピオイド、その他の中枢神経抑制剤と共に摂取すると、それらの作用を増強する。これは多くの場合鎮静作用の増加、協調運動障害、呼吸抑制などの副作用を増強し、死に至ることがある[110][111]。 制酸薬は、ベンゾジアゼピンの吸収を遅くすることがあるが、しかしこの効果はわずかであり一定していない[110]。
歴史
編集最初に発見されたベンゾジアゼピンはクロルジアゼポキシドであり、1955年にホフマン・ラ・ロシュのレオ・スターンバックによって開発された。
当初、この新薬グループは医療関係者の間で歓迎されたが、しかし徐々に問題が発覚し、1980年代には依存性リスクが発見された。ベンゾジアゼピンは、英国にて14,000人の患者および1,800の法律事務所による史上最大の集団訴訟を引き起こしたという歴史を持っている。その訴訟事項は、製薬メーカーは依存の可能性を知っていたが、医師に対して意図的にこの情報を差し控えたというものであった。同時に117人のGP医と50の保健当局を対象とし、ベンゾジアゼピン依存症とベンゾジアゼピン離脱症候群といった有害な副作用についての損害賠償を患者から起こされた。この事件により、医師は患者をベンゾジアゼピン系で治療する前に、患者に対して依存性と離脱症候群リスクについて適切な警告を行い、患者はリスク説明を受けたという同意書に署名が求められるようになった[112]。
医薬品製造者に対しての訴訟のほうは判決に至らなかった。コンサルタントの精神科医、専門家証人は利害の対立があり、legal aidは取り下げるという申し立てがあった。
これらの訴訟により、英国法はクラスアクション訴訟を起こすのをより難しくする方向に改正された[113]。
2010年には、イギリス医学研究審議会(MRC)の文章にて、評議会は30年前にて研究結果を知っていたことが明らかになった。それはベンゾジアゼピンは一部の人々において、アルコール乱用で発生するものと同様の脳の損傷を引き起こす可能性があるが、大規模な臨床試験ではフォローアップに失敗したという内容であった。1980年にMRCはLader教授とアシュトン教授により、ベンゾジアゼピンが脳に永久的な効果を引き起こすという研究提案を受けたが、それを断ったという。MRCはこの分野で要求基準を満たしていれば研究提案は常に開かれていると回答している。MRCの文章は大規模な集団訴訟に関連したもので、それは1980年代中盤から始まった製薬会社に関連している。ある弁護士はMRCがそれを隠し持っていたのは奇妙だと述べた。
イギリス労働党議員のJim Dobbin医師は、精神安定剤中毒に関する超党派議員団の議長を務めており、この文章は巨大なスキャンダルだとし、ベンゾジアゼピン服用の結果として、多数の人々が身体的・認知的・精神的な問題を引き起こしており、それは断薬後も継続していると述べている[114]。
抗不安効果を持つ抗うつ薬が導入され、ベンゾジアゼピン有害作用についての意識が高まっているものの、短期的な不安軽減のための処方は大幅には減少していない[6]。不眠症の治療薬としては、ベンゾジアゼピンはZ薬であるゾルピデム、ザレプロン、エスゾピクロンなどと比べ主流ではなくなった[115]。Z薬はBZDと分子的に異なっているが、同じベンゾジアゼピン受容体に作用し似たような鎮静作用を生み出す[116]。
ベンゾジアゼピンが登場する作品
編集脚注
編集注釈
編集出典
編集- ^ 日本臨床薬理学会『臨床薬理学』(第3版)医学書院、2011年、313頁。ISBN 978-4-260-01232-4。
- ^ a b Page C, Michael C, Sutter M, Walker M, Hoffman BB (2002). Integrated Pharmacology (2nd ed.). C.V. Mosby. ISBN 978-0723432210
- ^ a b Olkkola KT, Ahonen J (2008). “Midazolam and other benzodiazepines”. Handb Exp Pharmacol 182 (182): 335-60. doi:10.1007/978-3-540-74806-9_16. PMID 18175099.
- ^ a b Dikeos DG, Theleritis CG, Soldatos CR (2008). “Benzodiazepines: effects on sleep”. In Pandi-Perumal SR, Verster JC, Monti JM, Lader M, Langer SZ (eds.). Sleep Disorders: Diagnosis and Therapeutics. Informa Healthcare. pp. 220-2. ISBN 0-415-43818-7
- ^ a b c Saïas T, Gallarda T (2008). “[Paradoxical aggressive reactions to benzodiazepine use: a review]” (French). Encephale 34 (4): 330–6. doi:10.1016/j.encep.2007.05.005. PMID 18922233.
- ^ a b Lader M (2008). “Effectiveness of benzodiazepines: do they work or not?” (PDF). Expert Rev Neurother 8 (8): 1189-91. doi:10.1586/14737175.8.8.1189. PMID 18671662.
- ^ a b c d Lader M, Tylee A, Donoghue J (2009). “Withdrawing benzodiazepines in primary care”. CNS Drugs 23 (1): 19-34. doi:10.2165/0023210-200923010-00002. PMID 19062773.
- ^ a b c d e f g h i Ashton CH (2005). “The diagnosis and management of benzodiazepine dependence”. Curr Opin Psychiatry 18 (3): 249–55. doi:10.1097/01.yco.0000165594.60434.84. PMID 16639148.
- ^ a b c Ashton H (2004). “Benzodiazepine dependence”. In Haddad P, Dursun S, Deakin B (eds.). Adverse Syndromes and Psychiatric Drugs: A Clinical Guide. Oxford University Press. pp. 239-60. ISBN 978-0198527480
- ^ a b McIntosh A, Semple D, Smyth R, Burns J, Darjee R (2005). “Depressants”. Oxford Handbook of Psychiatry (1st ed.). Oxford University Press. p. 540. ISBN 0-19-852783-7
- ^ Billioti de Gage, Sophie; Bernard Bégaud, Fabienne Bazin, Hélène Verdoux, Jean-François Dartigues, Karine Pérès, Tobias Kurth, Antoine Pariente (September 2012). “Benzodiazepine use and risk of dementia: prospective population based study”. BMJ. doi:10.1136/bmj.e6231.
- ^ Imfeld P, Bodmer M, Jick SS, Meier CR (2015-10). “Benzodiazepine Use and Risk of Developing Alzheimer's Disease or Vascular Dementia: A Case-Control Analysis”. en:Drug safety 38 (10): 909-19. doi:10.1007/s40264-015-0319-3. PMID 26123874.
- ^ Allison C, Pratt JA (May 2003). “Neuroadaptive processes in GABAergic and glutamatergic systems in benzodiazepine dependence”. Pharmacol. Ther. 98 (2): 171–95. doi:10.1016/S0163-7258(03)00029-9. PMID 12725868.
- ^ Galanter, Marc; Kleber, Herbert D (2008-07-01). The American Psychiatric Publishing Textbook of Substance Abuse Treatment (4th ed.). United States of America: American Psychiatric Publishing Inc. p. 58. ISBN 978-1-58562-276-4
- ^ American College of Obstetricians and Gynecologists Committee on Practice Bulletins—Obstetrics (April 2008). “ACOG Practice Bulletin no. 92: Use of psychiatric medications during pregnancy and lactation”. Obstet Gynecol 111 (4): 1001–20. doi:10.1097/AOG.0b013e31816fd910. PMID 18378767. 非専門家向けの内容要旨.
- ^ a b Fraser AD (1998). “Use and abuse of the benzodiazepines”. Ther Drug Monit 20 (5): 481–9. doi:10.1097/00007691-199810000-00007. PMID 9780123.
- ^ a b Charlson F, Degenhardt L, McLaren J, Hall W, Lynskey M (2009). “A systematic review of research examining benzodiazepine-related mortality”. Pharmacoepidemiol Drug Saf 18 (2): 93–103. doi:10.1002/pds.1694. PMID 19125401.
- ^ a b White JM, Irvine RJ (1999). “Mechanisms of fatal opioid overdose”. Addiction 94 (7): 961–72. doi:10.1046/j.1360-0443.1999.9479612.x. PMID 10707430.
- ^ Lader MH (1999). “Limitations on the use of benzodiazepines in anxiety and insomnia: are they justified?”. E ur Neuropsychopharmacol 9 (Suppl 6): S399–405. doi:10.1016/S0924-977X(99)00051-6. PMID 10622686.
- ^ a b 英国国民医薬品集 2009, p. 189.
- ^ a b Perugi G, Frare F, Toni C (2007). “Diagnosis and treatment of agoraphobia with panic disorder”. CNS Drugs 21 (9): 741–64. doi:10.2165/00023210-200721090-00004. PMID 17696574.
- ^ Tesar GE (1990). “High-potency benzodiazepines for short-term management of panic disorder: the U.S. experience”. J Clin Psychiatry 51 (Suppl): 4–10; discussion 50–3. PMID 1970816.
- ^ Faught E (2004). “Treatment of refractory primary generalized epilepsy”. Rev Neurol Dis 1 (Suppl 1): S34–43. PMID 16400293.
- ^ Allgulander C, Bandelow B, Hollander E (2003). “WCA recommendations for the long-term treatment of generalized anxiety disorder”. CNS Spectr 8 (Suppl 1): 53–61. PMID 14767398.
- ^ a b mhGAP Intervention Guide for mental, neurological and substance use disorders in non-specialized health settings (Report). 世界保健機関. 2010. DRU3. ISBN 9789241548069。
- ^ “VALIUM ROCHE - PRESCRIBING INFORMATION 1998”. Roche Products Inc. (2008年1月). 2011年12月1日閲覧。
- ^ Stevens JC, Pollack MH (2005). “Benzodiazepines in clinical practice: consideration of their long-term use and alternative agents”. Journal of Clinical Psychiatry 66 (Suppl 2): 21–27. PMID 15762816. "The frequent use of benzodiazepines for the treatment of anxiety is likely a reflection of their effectiveness, rapid onset of anxiolytic effect, and tolerability."
- ^ a b c d e f McIntosh A, Cohen A, Turnbull N et al. (2004年). “Clinical guidelines and evidence review for panic disorder and generalised anxiety disorder”. National Collaborating Centre for Primary Care. 2009年6月16日閲覧。
- ^ Borwin Bandelow; Josef Zohar; Eric Hollander; Siegfried Kasper; Hans-Jürgen Möller & WFSBP Task Force on Treatment Guidelines for Anxiety, Obsessive-Compulsive and Posttraumatic Stress Disorders (October 2002). “World Federation of Societies of Biological Psychiatry (WFSBP) Guidelines for the Pharmacological Treatment of Anxiety, Obsessive-Compulsive and Posttraumatic Stress Disorders”. The World Journal of Biological Psychiatry (Informa Healthcare) 3 (4): 171–99. doi:10.3109/15622970209150621. PMID 12516310 2013年10月9日閲覧。.
- ^ a b c Work Group on Panic Disorder (January 2009). “APA Practice Guideline for the Treatment of Patients With Panic Disorder, Second Edition” (PDF). 2009年7月12日閲覧。
- ^ Barbui C, Cipriani A (2009年). “Proposal for the inclusion in the WHO Model List of Essential Medicines of a selective serotonin-reuptake inhibitor for Generalised Anxiety Disorder”. WHO Collaborating Centre for Research and Training in Mental Health. 2009年6月23日閲覧。
- ^ Cloos JM, Ferreira V (2009). “Current use of benzodiazepines in anxiety disorders”. Current Opinion in Psychiatry 22 (1): 90–95. doi:10.1097/YCO.0b013e32831a473d. PMID 19122540.
- ^ Martin JL, Sainz-Pardo M, Furukawa TA, Martin-Sanchez E, Seoane T, Galan C (September 2007). “Benzodiazepines in generalized anxiety disorder: heterogeneity of outcomes based on a systematic review and meta-analysis of clinical trials”. J. Psychopharmacol. (Oxford) 21 (7): 774-82. doi:10.1177/0269881107077355. PMID 17881433.
- ^ CG113 : Generalised anxiety disorder and panic disorder (with or without agoraphobia) in adults: Management in primary, secondary and community care (Report). 英国国立医療技術評価機構. 2011年1月.
- ^ Canadian Psychiatric Association (July 2006). “Clinical practice guidelines. Management of anxiety disorders” (PDF). Can J Psychiatry 51 (8 Suppl 2): 51S-55S. PMID 16933543. オリジナルの2010年7月14日時点におけるアーカイブ。 2009年8月8日閲覧。.
- ^ 王立オーストラリア総合医学会 2015, Chapt.2.3.
- ^ a b 王立オーストラリア総合医学会 2015, Chapt.2.2.
- ^ a b c d “Technology Appraisal Guidance 77. Guidance on the use of zaleplon, zolpidem and zopiclone for the short-term management of insomnia”. National Institute for Clinical Excellence (April 2004). 2008年12月3日時点のオリジナルよりアーカイブ。2009年7月26日閲覧。
- ^ a b c d Ramakrishnan K, Scheid DC (August 2007). “Treatment options for insomnia”. American Family Physician 76 (4): 517–26. PMID 17853625.
- ^ D. Maiuro PhD, Roland (2009-12-13). Handbook of Integrative Clinical Psychology, Psychiatry, and Behavioral Medicine: Perspectives, Practices, and Research. Springer Publishing Company. pp. 128–30. ISBN 0-8261-1094-0
- ^ a b c Buscemi N, Vandermeer B, Friesen C, Bialy L, Tubman M, Ospina M, Klassen TP, Witmans M (June 2005). “Manifestations and Management of Chronic Insomnia in Adults. Summary, Evidence Report/Technology Assessment: Number 125”. Agency for Healthcare Research and Quality. 2014年2月20日閲覧。
- ^ 王立オーストラリア総合医学会 2015, Summary of Recommendations.
- ^ a b 米国老年医学会, “Five Things Physicians and Patients Should Question”, Choosing Wisely: an initiative of the ABIM財団 (American Geriatrics Society) August 1, 2013閲覧。 は以下を挙げている。
- Finkle, W. D.; Der, J. S.; Greenland, S.; Adams, J. L.; Ridgeway, G.; Blaschke, T.; Wang, Z.; Dell, R. M. et al. (2011). “Risk of Fractures Requiring Hospitalization After an Initial Prescription for Zolpidem, Alprazolam, Lorazepam, or Diazepam in Older Adults”. Journal of the American Geriatrics Society 59 (10): 1883–1890. doi:10.1111/j.1532-5415.2011.03591.x. PMID 22091502.
- Allain, H.; Bentué-Ferrer, D.; Polard, E.; Akwa, Y.; Patat, A. (2005). “Postural instability and consequent falls and hip fractures associated with use of hypnotics in the elderly: A comparative review”. Drugs & aging 22 (9): 749–765. doi:10.2165/00002512-200522090-00004. PMID 16156679.
- American Geriatrics Society 2012 Beers Criteria Update Expert Panel (2012). “American Geriatrics Society Updated Beers Criteria for Potentially Inappropriate Medication Use in Older Adults”. Journal of the American Geriatrics Society 60 (4): 616–631. doi:10.1111/j.1532-5415.2012.03923.x. PMC 3571677. PMID 22376048.
- ^ 王立オーストラリア総合医学会 2015, Chapt.2.6.
- ^ Scottish Intercollegiate Guidelines Network (2005年). “Diagnosis and management of epilepsy in adults”. pp. 17–9. 2009年1月26日時点のオリジナルよりアーカイブ。2009年6月5日閲覧。
- ^ a b Stokes T, Shaw EJ, Juarez-Garcia A, Camosso-Stefinovic J, Baker R (October 2004). Clinical Guidelines and Evidence Review for the Epilepsies: diagnosis and management in adults and children in primary and secondary care. London: Royal College of General Practitioners. pp. 61, 64–65 2009年6月2日閲覧。
- ^ a b c Shorvon SD (March 2009). “Drug treatment of epilepsy in the century of the ILAE: the second 50 years, 1959-2009”. Epilepsia 50 (Suppl 3): 93–130. doi:10.1111/j.1528-1167.2009.02042.x. PMID 19298435.
- ^ Stokes T, Shaw EJ, Juarez-Garcia A, Camosso-Stefinovic J, Baker R (2004年10月). “Clinical Guidelines and Evidence Review for the Epilepsies: diagnosis and management in adults and children in primary and secondary care (Appendix B)”. London: Royal College of General Practitioners. p. 432. 2011年11月27日時点のオリジナルよりアーカイブ。2009年6月2日閲覧。
- ^ Ashworth M, Gerada C (1997). “ABC of mental health. Addiction and dependence—II: Alcohol”. BMJ 315 (7104): 358–60. doi:10.1136/bmj.315.7104.358. PMC 2127236. PMID 9270461.
- ^ 英国国民医薬品集 2009, p. 275.
- ^ Kraemer KL, Conigliaro J, Saitz R (1999). “Managing alcohol withdrawal in the elderly”. Drugs Aging 14 (6): 409–25. doi:10.2165/00002512-199914060-00002. PMID 10408740.
- ^ Prater CD, Miller KE, Zylstra RG (September 1999). “Outpatient detoxification of the addicted or alcoholic patient”. American Family Physician 60 (4): 1175–83. PMID 10507746.
- ^ 王立オーストラリア総合医学会 2015, Chapt.2.4.
- ^ Ebell MH (April 2006). “Benzodiazepines for alcohol withdrawal”. American Family Physician 73 (7): 1191. PMID 16623205.
- ^ Peppers MP (1996). “Benzodiazepines for alcohol withdrawal in the elderly and in patients with liver disease”. Pharmacotherapy 16 (1): 49–57. PMID 8700792.
- ^ 英国国民医薬品集 2009, pp. 577–578.
- ^ Manon-Espaillat R, Mandel S (1999). “Diagnostic algorithms for neuromuscular diseases”. Clin Podiatr Med Surg 16 (1): 67-79. PMID 9929772.
- ^ Kamen, L.; Henney, HR.; Runyan, JD. (February 2008). “A practical overview of tizanidine use for spasticity secondary to multiple sclerosis, stroke, and spinal cord injury”. Curr Med Res Opin 24 (2): 425-39. doi:10.1185/030079908X261113. PMID 18167175.
- ^ Devlin JW, Roberts RJ (July 2009). “Pharmacology of commonly used analgesics and sedatives in the ICU: benzodiazepines, propofol, and opioids”. Crit Care Clin 25 (3): 431–49, vii. doi:10.1016/j.ccc.2009.03.003. PMID 19576523.
- ^ 英国国民医薬品集 2009, p. 693.
- ^ Wyatt JP, Illingworth RN, Robertson CE, Clancy MJ, Munro PT (2005). “Poisoning”. Oxford Handbook of Accident and Emergency Medicine (2nd ed.). Oxford University Press. pp. 173–208. ISBN 978-0-19-852623-0
- ^ Zimbroff DL (2008). “Pharmacological control of acute agitation: focus on intramuscular preparations”. CNS Drugs 22 (3): 199–212. doi:10.2165/00023210-200822030-00002. PMID 18278976.
- ^ Attard, A.; Ranjith, G.; Taylor, D. (August 2008). “Delirium and its treatment”. CNS Drugs 22 (8): 631–44. doi:10.2165/00023210-200822080-00002. PMID 18601302.
- ^ Schatzberg, Alan F.; Nemeroff, Charles B., eds (2009-05-06). The American Psychiatric Publishing Textbook of Psychopharmacology (Fourth ed.). American Psychiatric Publishing. p. 470. ISBN 978-1-58562-309-9
- ^ Bandelow B (September 2008). “The medical treatment of obsessive-compulsive disorder and anxiety”. CNS Spectr 13 (9 Suppl 14): 37–46. PMID 18849910.
- ^ Gallegos J, Vaidya P, D'Agati D, Jayaram G, Nguyen T, Tripathi A, Trivedi JK, Reti IM (June 2012). “Decreasing adverse outcomes of unmodified electroconvulsive therapy: suggestions and possibilities”. J ECT 28 (2): 77–81. doi:10.1097/YCT.0b013e3182359314. PMID 22531198.
- ^ “Development of a rational scale to assess the harm of drugs of potential misuse”. Lancet 369 (9566): 1047–53. (March 2007). doi:10.1016/S0140-6736(07)60464-4. PMID 17382831.
- ^ a b c Ballenger JC (2000). “Benzodiazepine receptors agonists and antagonists”. In Sadock VA, Sadock BJ, Kaplan HI (eds.). Kaplan & Sadock's Comprehensive Textbook of Psychiatry (7th ed.). Lippincott Williams & Wilkins. pp. 2317-23. ISBN 0-683-30128-4
- ^ a b Tasman A, Lieberman JA (2006). Handbook of Psychiatric Drugs. Wiley. p. 151. ISBN 0-470-02821-1
- ^ Stone KL, Ensrud KE, Ancoli-Israel S (September 2008). “Sleep, insomnia and falls in elderly patients”. Sleep Med. 9 Suppl 1: S18-22. doi:10.1016/S1389-9457(08)70012-1. PMID 18929314.
- ^ Rapoport MJ, Lanctot KL, Streiner DL (2009). “Benzodiazepine use and driving: a meta-analysis”. J Clin Psychiatry 70 (5): 663-73. doi:10.4088/JCP.08m04325. PMID 19389334.
- ^ Orriols L, Salmi LR, Philip P (2009). “The impact of medicinal drugs on traffic safety: a systematic review of epidemiological studies”. Pharmacoepidemiol Drug Saf 18 (8): 647-58. doi:10.1002/pds.1763. PMC 2780583. PMID 19418468.
- ^ 英国国民医薬品集 2009, pp. 183–189.
- ^ "benzodiazepines-oral" - medicinenet.com
- ^ Riss, J.; Cloyd, J.; Gates, J.; Collins, S. (August 2008). “Benzodiazepines in epilepsy: pharmacology and pharmacokinetics”. Acta Neurol Scand 118 (2): 69–86. doi:10.1111/j.1600-0404.2008.01004.x. PMID 18384456.
- ^ a b Paton C (2002). “Benzodiazepines and disinhibition: a review”. Psychiatr Bull R Coll Psychiatr 26 (12): 460–2. doi:10.1192/pb.26.12.460.
- ^ Bond AJ (1998). “Drug-induced behavioural disinhibition: incidence, mechanisms and therapeutic implications”. CNS Drugs 9 (1): 41–57. doi:10.2165/00023210-199809010-00005.
- ^ Drummer OH (2002). “Benzodiazepines—effects on human performance and behavior”. Forensic Sci Rev 14 (1–2): 1–14.
- ^ a b Ashton H (2007). “Drug dependency: benzodiazepines”. In Ayers S, Baum A, McManus C, Newman S (eds.). Cambridge Handbook of Psychology, Health and Medicine (2nd ed.). Cambridge University Press. pp. 675–8. ISBN 978-0-521-87997-2
- ^ a b Barker MJ, Greenwood KM, Jackson M, Crowe SF (2004). “Cognitive effects of long-term benzodiazepine use: a meta-analysis”. CNS Drugs 18 (1): 37–48. doi:10.2165/00023210-200418010-00004. PMID 14731058.
- ^ a b c Stewart SA (2005). “The effects of benzodiazepines on cognition”. J Clin Psychiatry 66 (Suppl 2): 9–13. PMID 15762814. オリジナルの2011年7月15日時点におけるアーカイブ。.
- ^ Hammersley D, Beeley L (1996). “The effects of medication on counselling”. In Palmer S, Dainow S, Milner P (eds.). Counselling: The BACP Counselling Reader. 1. Sage. pp. 211-4. ISBN 978-0803974777
- ^ “Benzodiazepine Use and Risk of Dementia in the Elderly Population: A Systematic Review and Meta-Analysis”. Neuroepidemiology 47 (3-4): 181–191. (2016). doi:10.1159/000454881. PMID 28013304.
- ^ Aleman, André; Zhong, GuoChao; Wang, Yi; et al. (2015). “Association between Benzodiazepine Use and Dementia: A Meta-Analysis”. PLOS ONE 10 (5): e0127836. doi:10.1371/journal.pone.0127836. PMC 4446315. PMID 26016483.
- ^ 若倉雅登「快適な視覚とそれを乱すもの」『化学教育』第65巻第3号、2017年、142-143頁、doi:10.20665/kakyoshi.65.3_142、NAID 130006038453。
- ^ a b 王立オーストラリア総合医学会 2015, Chapt.5.
- ^ a b “Treatment of Benzodiazepine Dependence.”. ncbi. 2019年7月8日閲覧。
- ^ Longo LP, Johnson B (April 2000). “Addiction: Part I. Benzodiazepines--side effects, abuse risk and alternatives”. American Family Physician 61 (7): 2121–8. PMID 10779253.
- ^ Nardi AE, Perna G (May 2006). “Clonazepam in the treatment of psychiatric disorders: an update”. Int Clin Psychopharmacol 21 (3): 131–42. doi:10.1097/01.yic.0000194379.65460.a6. PMID 16528135.
- ^ a b Chouinard G (2004). “Issues in the clinical use of benzodiazepines: potency, withdrawal, and rebound”. J Clin Psychiatry 65 (Suppl 5): 7–12. PMID 15078112. オリジナルの2011年7月15日時点におけるアーカイブ。.
- ^ Harrison PC, Gelder MG, Cowen P (2006). “The misuse of alcohol and drugs”. Shorter Oxford Textbook of Psychiatry (5th ed.). Oxford University Press. pp. 461-2. ISBN 0-19-856667-0
- ^ Longmore M, Scally P, Collier J (2003). “Chapter 4”. Oxford Handbook of Clinical Specialties (6th ed.). Oxford University Press. p. 366. ISBN 0-19-852518-4
- ^ Ashton CH (1991). “Protracted withdrawal syndromes from benzodiazepines”. J Subst Abuse Treat 8 (1-2): 19-28. doi:10.1016/0740-5472(91)90023-4. PMID 1675688.
- ^ 英国国民医薬品集 2009, pp. 183–184.
- ^ a b c ヘザー・アシュトン『ベンゾジアゼピン - それはどのように作用し、離脱するにはどうすればよいか』(pdf)Professor C H Ashton、2002年8月。2013年1月19日閲覧。
- ^ Lal R, Gupta S, Rao R, Kattimani S (2007). “Emergency management of substance overdose and withdrawal”. Substance Use Disorder. World Health Organization (WHO). p. 82 2009年6月6日閲覧。
- ^ Ebadi, Manuchair (2007-10-23). “Alphabetical presentation of drugs”. Desk Reference for Clinical Pharmacology (2nd ed.). USA: CRC Press. p. 512. ISBN 978-1420047431
- ^ Overdose Death Rates. By National Institute on Drug Abuse (NIDA).
- ^ Gaudreault P, Guay J, Thivierge RL, Verdy I (1991). “Benzodiazepine poisoning. Clinical and pharmacological considerations and treatment”. Drug Saf 6 (4): 247–65. doi:10.2165/00002018-199106040-00003. PMID 1888441.
- ^ a b Jones, Christopher M.; Mack, Karin A.; Paulozzi, Leonard J. (February 2013). “Pharmaceutical Overdose Deaths, United States, 2010”. JAMA 309 (7): 657. doi:10.1001/jama.2013.272. PMID 23423407.
- ^ Robin Mantooth (2010年1月28日). “Toxicity, benzodiazepine”. eMedicine. 2010年10月2日閲覧。
- ^ a b Ramrakha P, Moore K (2004). “Chapter 14: Drug overdoses”. Oxford Handbook of Acute Medicine (2nd ed.). Oxford University Press. pp. 791–838 (798). ISBN 0-19-852072-7
- ^ Klein-Schwartz W, Oderda GM (1991). “Poisoning in the elderly. Epidemiological, clinical and management considerations”. Drugs Aging 1 (1): 67–89. doi:10.2165/00002512-199101010-00008. PMID 1794007.
- ^ 上條吉人 著、相馬一亥(監修) 編『臨床中毒学』医学書院、2009年10月、99頁。ISBN 978-4-260-00882-2。
- ^ Seger DL (2004). “Flumazenil—treatment or toxin”. J Toxicol Clin Toxicol 42 (2): 209–16. doi:10.1081/CLT-120030946. PMID 15214628.
- ^ “Treatment of benzodiazepine overdose with flumazenil. The flumazenil in benzodiazepine intoxication multicenter study group”. Clin Ther 14 (6): 978–95. (1992). PMID 1286503.
- ^ Spivey WH (1992). “Flumazenil and seizures: analysis of 43 cases”. Clin Ther 14 (2): 292–305. PMID 1611650.
- ^ Goldfrank LR (2002). Goldfrank's Toxicologic Emergencies. McGraw-Hill. ISBN 0-07-136001-8
- ^ Meyler L, Aronson JK, ed (2006). Meyler's Side Effects of Drugs: the International Encyclopedia of Adverse Drug Reactions and Interactions (15th ed.). Elsevier. pp. 429-43. ISBN 0-444-50998-4
- ^ a b c Moody D (2004). “Drug interactions with benzodiazepines”. In Raymon LP, Mozayani A (eds.). Handbook of Drug Interactions: a Clinical and Forensic Guide. Humana. pp. 3-88. ISBN 1-58829-211-8
- ^ a b Norman TR, Ellen SR, Burrows GD (1997). “Benzodiazepines in anxiety disorders: managing therapeutics and dependence”. Med J Aust 167 (9): 490-5. PMID 9397065.
- ^ King MB (1992). “Is there still a role for benzodiazepines in general practice?”. Br J Gen Pract 42 (358): 202-5. PMC 1372025. PMID 1389432.
- ^ Peart R (1999年6月1日). “Memorandum by Dr Reg Peart”. Minutes of Evidence. Select Committee on Health, House of Commons, UK Parliament. 2009年5月27日閲覧。
- ^ Nina Lakhani (2010年11月7日). “Drugs linked to brain damage 30 years ago”. United Kingdom: The Independent on Sunday
- ^ Jufe, GS. (Jul-Aug 2007). “[New hypnotics: perspectives from sleep physiology]”. Vertex 18 (74): 294-9. PMID 18265473.
- ^ Lemmer B (2007). “The sleep?wake cycle and sleeping pills”. Physiol Behav 90 (2-3): 285-93. doi:10.1016/j.physbeh.2006.09.006. PMID 17049955.
参考文献
編集- Royal Pharmaceutical Society of Great Britain (2009). 英国国民医薬品集 (BNF 57). BMJ Group and RPS Publishing. ISBN 9780853698456
- Prescribing drugs of dependence in general practice, Part B Benzodiazepines (Report). 王立オーストラリア総合医学会. 2015年7月.
- ベンゾジアゼピン系薬物に関する要望書(薬害オンブズパースン会議 2015年10月28日) (PDF)
- ベンゾジアゼピン情報センター